 |
Нарушение толерантности к глюкозе при неэндокринных заболеваниях
|
|
|
|
Патогенез «стрессорной гипергликемии», связанной с такими острыми заболеваниями, как сепсис или инфаркт миокарда, уже обсуждался. В таких условиях не следует проводить тесты на глюкозотолерантность (если они и показаны), пока не пройдет несколько недель или месяцев после выхода больного из острого состояния. В отличие от этого при некоторых патологических состояниях часто наблюдаются хронические нарушения толерантности к глюкозе даже без острого ухудшения течения основного патологического процесса. При уремии на фоне гиперинсулинемии и легкой гипергликемии натощак отмечается высокая гипергликемия после еды. Основными патогенетическими факторами гипергликемии являются резистентность к инсулину и гиперчувствительность к глюкагону [280].
Нарушение толерантности к глюкозе часто обнаруживается и при циррозе печени, особенно если он сопровождается портальной гипертензией. В этих случаях отмечены гиперинсулинемия, а также гиперглюкагонемия. Снижение чувствительности печени к глюкагону при циррозе свидетельствует о том, что инсулинорезистентность может играть более важную патогенетическую роль в нарушении углеводного обмена [92].
Глава 11. ГИПОГЛИКЕМИЯ
Р. С. ШЕРВИН (R. S. SHERWIN), Ф. ФЕЛИГ (РН. FELIG)
ВВЕДЕНИЕ
В норме концентрация глюкозы в плазме в течение суток колеблется в относительно узких границах. У здоровых лиц, потребляющих смешанную пищу, уровень глюкозы в плазме в течение суток остается в пределах 600—1200 мг/л. Однако при патологических состояниях может произойти уменьшение содержания глюкозы в плазме, что часто представляет значительные трудности для диагностики и лечения. Гипогликемия может быть основным проявлением патологического процесса (у больных с инсулинпродуцирующими опухолями островковых клеток), служить сравнительно редким его признаком (при аддисоновой болезни) или клинически вообще не проявляться (при вирусном гепатите). Признаки и симптомы гипогликемии относительно неспецифичны и могут быть спутаны с другими органическими нарушениями (первичные расстройства функций центральной нервной системы) или функциональными изменениями (состояние страха, неврозы). Проблему еще больше усложняет отсутствие единого мнения а отношении точной нижней границы нормы для концентрации глюкозы в плазме. Все эти неопределенности обычно заставляют врача,. когда речь идет о гипогликемии, чувствовать себя гораздо менее уверенным, чем когда речь идет о диагностике и лечении диабета.. Тем не менее имеется достаточно данных, позволяющих сформировать строгий подход к диагностике и лечению гипогликемических состояний.
|
|
|
ОПРЕДЕЛЕНИЕ
Гипогликемию легче определить в клинических понятиях, чем в точных количественных терминах. Она представляет собой снижение содержания глюкозы в плазме до уровня, обусловливающего появление клинических симптомов, которые обычно исчезают после нормализации содержания глюкозы. Вызовет ли сниженное количество глюкозы в плазме симптом гипогликемии или нет, зависит от таких факторов, как: 1) пол больного; 2) быстрота снижения содержания глюкозы в плазме; 3) концентрация глюкозы в плазме, предшествующая снижению ее. Что касается половых различий, то у здоровой женщины уровень глюкозы в плазме при 72-часовом голодании оказывается на 100—150 мг/л ниже, чем в тех же условиях у здорового мужчины [1, 2]. Механизм половых различий точно не выяснен, хотя они могут быть связаны с меньшим поступлением в кровь образующихся из белка предшественников глюкозы (аланин) у женщин [3]. На роль быстроты снижения гликемии указывают данные о том, что у некоторых лиц постепенное снижение концентрации глюкозы в плазме до 400 мг/л после приема пищи не вызывает никаких симптомов [4]. В отличие от этого резкое снижение уровня глюкозы до того же уровня, вызываемое инсулином, почти всегда сопровождается клинической симптоматикой 1.
|
|
|
Роль предшествующей концентрации глюкозы иллюстрируется наблюдениями, в которых острое снижение уровня глюкозы в плазме у больных диабетом с хронической гипергликемией может обусловливать симптомы и вторичный выброс контррегуляторных гормонов при уровне глюкозы в крови 900—1000 мг/л, что укладывается в пределы колебаний гликемии в норме [5]. В отличие от этого, если у здорового человека остро повысить уровень глюкозы в крови до 2000—3000 мг/л, а затем столь же остро снижать его, секреция контррегуляторных гормонов не наступает, пока уровень глюкозы в плазме не снизится до 500 мг/л или ниже [6].
Несмотря на все эти неопределенности, можно дать следующие определения гипогликемии, пригодные для практики: 1) у взрослых мужчин и женщин после ночного голодания уровень глюкозы в плазме ниже 600 мг/л; 2) у мужчин, голодавших в течение 72 ч, уровень глюкозы в плазме ниже 550 мг/л; 3) у женщин, голодавших в течение 72 ч, уровень глюкозы в плазме ниже 450 мг/л; 4) у мужчин и женщин, получивших внутрь нагрузку глюкозой в количестве 75—100 г, самый низкий уровень глюкозы в плазме не достигает 500 мг/л.
ПРИЗНАКИ И СИМПТОМЫ
Клинические проявления гипогликемии обусловлены двумя факторами: 1) дефицитом снабжения глюкозой головного мозга (нейрогликемия) и сопровождающим его снижением потребления мозгом кислорода: 2) стимуляцией симпатоадреналовой системы, в результате чего усиливается секреция катехоламинов. Нейрогликопенические симптомы включают головную боль, невозможность сосредоточиться, утомляемость, помрачение сознания, неадекватное поведение, галлюцинации и, наконец, судороги и кому. Судороги могут быть как местными, так и генерализованными. Кроме того, могут возникать локальные нарушения функции центральной нервной системы, такие, как гемиплегия или афазия. Эти признаки чаще появляются у пожилых лиц с предшествующей патологией сосудов головного мозга и могут создавать впечатление острых нарушений мозгового кровообращения. Повторные длительные приступы гипогликемии могут лежать в основе хроническом мозгового синдрома со стойким снижением интеллекта.
|
|
|
Исключение составляют лица, голодавшие в течение очень длительного времени (3 нед или более). В таких условиях утилизация кетоновых тел мозгом смягчает проявление симптоматики инсулиновой гипогликемии.
Симптомы, обусловленные стимуляцией симпатоадреналовой системы, включают сердцебиение, возбуждение, потливость, дрожь, чувство голода. Эти симптомы нередко формируют ранний симптомокомплекс, служащий предвестником надвигающегося приступа гипогликемии, поскольку они, по всей вероятности, предшествуют нарушению функций коры головного мозга. Сам больной может «оборвать» приступ, приняв глюкозу. О значении этих симптомов наглядно свидетельствует положение больных с инсулинозависимым диабетом, у которых развилась нейропатия или которых лечат b-адреноблокаторами. У таких больных гипогликемия может прогрессировать до комы без предвестников, которые позволили бы больному оборвать приступ.
Главный нерешенный вопрос касается относительной роли секреции гормонов мозгового слоя надпочечников, с одной стороны, и активации симпатической нервной системы — с другой, в генезе развития симптомов гипогликемии и участии в контррегуляторной реакции на нее [7]. Нет сомнений в том, что резкое снижение уровня глюкозы в крови (при введении инсулина) или развитие внутриклеточной глюкопении (под действием конкурентных ингибиторов утилизации глюкозы, таких, как 2-дезоксиглюкоза) приводит к быстрому повышению содержания в плазме адреналина и норадреналина, а также к усилению секреции гормона роста, кортизола и глюкагона [8] (рис. 11—1). Больше того, временная зависимость между повышением уровня этих гормонов и прекращением влияния инсулина на кинетику глюкозы указывает на то, что именно катехоламины оказывают главное контррегуляторное действие [8, 9]. Тем не менее у лиц, перенесших адреналэктомию [10], и больных с перерывом шейного отдела спинного мозга или перенесших тораколюмбальную симпатэктомию [10, 11] наблюдали восстановление уровня глюкозы в крови после инсулиновой гипогликемии. В целом имеющиеся данные свидетельствуют о том, что при острой гипогликемии усиливается как секреторная функция мозгового слоя надпочечников, так и активность симпатической нервной системы; оба механизма принимают участие в восстановлении уровня сахара в крови.
|
|
|
Симптомы гипогликемии независимо от механизма их развития отличаются эпизодическим характером. Хотя они могут неоднократно повторяться, продолжаются они, как правило, в течение нескольких минут или часов, а не дней или недель. Эта относительная кратковременность объясняется тем, что гипогликемия должна очень быстро завершиться одним из трех исходов: 1) уровень глюкозы в плазме спонтанно восстановится до нормы в силу «срабатывания» контррегуляторных механизмов; 2) прием пищи приведет к нормализации содержания глюкозы в плазме; 3) если не произойдет ни того, ни другого, то концентрация глюкозы в плазме достигнет уровня, который вызывает обморочное состояние, паралич или кому. У больных, предъявляющих жалобы на утомляемость, слабость или невозможность сосредоточиться, продолжающиеся в течение дней, недель или месяцев без четких эпизодических приступов ухудшения состояния, гипогликемия или ее участие в патогенезе перечисленных симптомов маловероятны.
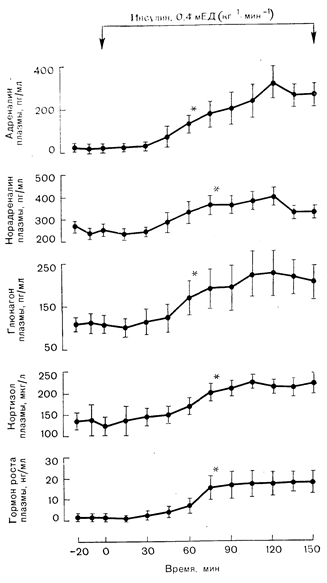
Рис. 11 — 1. Реакция контррегуляторных гормонов на инсулиновую гипогликемию. Инфузия инсулина обусловила снижение уровня глюкозы в-плазме до 500—550 мг/л (на рисунке не показано) и вызвала увеличение концентрации в плазме адреналина, норадреналина, глюкагона, кортизола и гормона роста. Звездочками обозначены первые временные точки, в которых концентрация гормона в плазме значимо превысила исходный уровень (по Sacca et al., J. Clin. Invest, 1979, 63, 849).
Вторая важная особенность симптомов гипогликемии касается реакции на прием содержащих глюкозу пищевых продуктов или напитков. Субъективное улучшение состояния, связанное с приемом глюкозы, не является специфическим признаком гипогликемии. Прием глюкозы может облегчать проявление многих симптомов, характерных для тревожных состояний по механизму действия плацебо (см. ниже). Если в ходе обследования у больного появятся соответствующие симптомы, врач должен взять пробу крови для определения содержания глюкозы в крови до попытки снять появившиеся симптомы введением глюкозы.
|
|
|
Сравнительно часто у коматозных или находящихся в тяжелом ступоре больных с гипогликемией обнаруживается гипотермия [12]. Это особенно характерно для больных с алкогольной гипогликемией. Хотя гипотермия и служит полезным диагностическим признаком при обследовании коматозного больного, она также не специфична для гипогликемии, поскольку может развиться и при.лекарственных отравлениях (особенно барбитуратами), переохлаждении и микседематозной коме.
СИНДРОМ НЕГИПОГЛИКЕМИИ
В последние годы все больше возрастает тенденция к самодиагностике возможной гипогликемии. Отчасти это объясняется обилием информации в популярных журналах и книгах, предназначенных для непрофессионалов, в которых подчеркивается «частота и важность» гипогликемии, выступающей в качестве причины разнообразных симптомов — от снижения физической или умственной работоспособности до нарушения сексуальной потенции. Классический совет студентам-медикам постоянно помнить о гипогликемии как о возможной причине нервно-психических расстройств в настоящее время следует сформулировать иначе: нужно остерегаться ошибочного диагноза гипогликемии у больных, предъявляющих разнообразные жалобы [13]. Характерный пример синдрома «негипогликемии» отмечается у лиц, предъявляющих жалобы на чувство тревоги, утомляемость, головную боль, головокружение, сердцебиение и слабость, которые могут быть и эпизодическими, но часто сохраняются в течение дней и недель. Такие больные обычно говорят о том, что частота приступов уменьшается, а общее самочувствие улучшается при резком ограничении углеводов в диете. С другой стороны, уже начавшийся приступ им якобы удается «купировать» приемом большого количества углеводов. Отсутствие гипогликемии (синдром негипогликемии) у таких больных устанавливают путем тщательного сбора анамнеза, чтобы выяснить, имеют ли симптомы эпизодический характер, а затем путем выявления нормальной реакции уровня глюкозы в крови при голодании и/или после введения глюкозы или приема пищи. Полученные данные врач должен подробно объяснить больному, подчеркнув, что симптомы, указывающие на возможную гипогликемию, могут обусловливаться другими причинами (например, депрессией, тревожным состоянием) и что купирование симптомов приемом сахара или профилактика приступов диетическими ограничениями могут отражать эффект плацебо. Затем следует сосредоточить усилия на выяснении психологических или органических факторов, определяющих жалобы больного. О важности правильного диагноза и вскрытии причин субъективных симптомов свидетельствует тот факт, что самодиагностика гипогликемии может довести больного до такого состояния, что он отказывается питаться в ресторанах, чтобы по ошибке не съесть даже небольшое количество углеводов, или ездить в автомобиле, чтобы не потерять возможности немедленно принять сахар, когда у него появятся соответствующие симптомы. Такие больные требуют самого пристального внимания со стороны врача, чтобы не-дать нм превратиться в «инвалидов диеты».
КЛАССИФИКАЦИЯ
Различные попытки классифицировать гипогликемию, исходя и» ее патогенетических механизмов (т. е. нарушения продукции глюкозы или ее утилизации) часто оказывались безуспешными из-за множественности причин, которые могут принимать участие в развитии конкретных патологических состояний. Для клиницистов более полезна классификация, основанная на характеристике условий, в которых развивается гипогликемия. С этих позиций можно выделить три основные вида гипогликемии: натощак, после еды и индуцированная гипогликемия (табл. 11—1). При гипогликемии натощак наиболее резкое снижение уровня глюкозы в плазме развивается при воздержании от пищи; таким образом, не нужно принимать пищу, чтобы вызвать приступ. В отличие от этого при гипогликемии после еды голодание не сопровождается чрезмерным снижением уровня глюкозы, тогда как после приема пищи (обычно через 2—5 ч) развивается гипогликемия. При индуцированной гипогликемии снижение уровня глюкозы в плазме определяется введением лекарственных средств (например, инсулина) или приемом с пищей веществ, обладающих токсическими свойствами (например, алкоголя, незрелых плодов Blighia sapida).
Таблица 11—1. Основные виды гипогликемии и некоторые часто встречающиеся примеры их
Гипогликемия натощак
Инсулинпродуцирующая опухоль островковых клеток
Гипогликемия новорожденных с кетозом Гипогликемия после еды
Спонтанная реактивная гипогликемия
Ранние стадии сахарного диабета Индуцированная гипогликемия
Алкогольная гипогликемия
Передозировка инсулина
ГИПОГЛИКЕМИЯ НАТОЩАК
Гипогликемия натощак характеризуется неэффективностью поддержания нормального гомеостаза глюкозы в условиях воздержания от пищи. При таких состояниях не требуется приема пиши, ни введения каких-либо лекарственных веществ или токсинов, чтобы вызвать гипогликемию. Патофизиологию, диагностику и лечение таких расстройств легче всего представить при сопоставлении с реакцией на голод у здоровых лиц.
ГОЛОДАНИЕ ЗДОРОВЫХ ЛИЦ
В норме человек принимает пищу с перерывами, которые варьируют от 2 до 14 ч. Иногда, однако, либо в силу добровольного отказа ют пищи, либо из-за какого-то привходящего заболевания, либо, наконец, из-за отсутствия пищи людям приходится голодать в течение более длительного времени. Метаболическая реакция на голодание объединяет в себе гормональные и субстратные изменения, направленные на: 1) сохранение продукции глюкозы (гликогенолиз и глюконеогенез) на уровне, покрывающем потребности тканей, облигатно зависимых от нее, особенно мозга; 2) увеличение мобилизации главных энергетических запасов (жир); 3) уменьшение расходования белков организма. Нормальную реакцию на голодание можно рассматривать как непрерывный процесс, который удается подразделить на три фазы: состояние натощак (6— 12 ч после приема пищи), кратковременное голодание (в течение 12—72 ч) и длительное голодание (2 нед и более) [14].
После ночного голодания (состояние натощак) печень усиленно продуцирует глюкозу, которая потребляется в основном мозгом. Скорость кругооборота глюкозы у взрослого человека в этом состоянии составляет 2—3 мг/кг в минуту. Продукция глюкозы печенью определяется гликогенолизом (который обеспечивает 75% выхода глюкозы) и глюконеогенезом (за счет которого продуцируются остальные 25%). Основными субстратами, используемыми печенью для глюконеогенеза, служат продукты гликолиза — лактат и пируват, аминокислоты, особенно аланин, и глицерин.
В состоянии натощак глюкоза в организме человека потребляется почти исключительно мозгом. Небольшие количества ее потребляются также форменными элементами крови. Совершенно иная ситуация характерна для инсулиночувствительных тканей, таких, как мышцы и жировая ткань, которые практически не потребляют глюкозу при голодании, длящемся 12 ч и более.
Главным гормональным сигналом, обеспечивающим плавный переход от состояния сытости к состоянию натощак без развития гипогликемии служит снижение уровня инсулина в плазме. Если через 1—3 ч после еды уровень его повышается до 30— 100 мкЕД/мл, то в состоянии натощак он снижается до 10— 20 мкЕД/мл. Именно эта исходная (а не после еды) концентрация инсулина является условием стимуляции процессов гликогенолиза и глюконеогенеза, обеспечивающей такую продукцию глюкозы печенью, которая соответствует сохраняющимся потребностям мозга. Кроме того, уменьшение концентрации инсулина до исходной служит сигналом для прекращения потребления глюкозы инсулиночувствительными мышечной и жировой тканями.
Если голодание продолжается более 12—14 ч, то включаются дополнительные механизмы сохранения эугликемии. Поскольку после ночного голодания запасы гликогена в печени составляют всего 70—90 г, а мозг утилизирует глюкозу со скоростью 125 г/сут, то при 24—48-часовом голодании печеночные запасы гликогена должны оказаться исчерпанными. В связи с этим поддержание печеночной продукции глюкозы и эугликемии требует прогрессивного нарастания глюконеогенеза в печени. Этот процесс в свою очередь зависит от мобилизации аланина и других аминокислот из мышечных запасов белка. Поглощение и превращение аланина в глюкозу в печени прогрессивно нарастает по мере увеличения длительности голодания более 12 ч. Кроме того, увеличивается и мобилизация жирных кислот из жировой ткани (т. е. стимулируется липолиз), что обеспечивает энергетическим материалом печень и мышцы. Помимо этого окисление жирных кислот в печени приводит к кетогенезу и прогрессивному повышению уровня b-оксибутирата и ацетоацетата в крови. Главным гормональным сигналом, обусловливающим увеличение мобилизации аминокислот, стимуляцию глюконеогенеза, липолиза и кетогенеза при длительности голодания более 12—14 ч, служит дальнейшее уменьшение концентрации инсулина в плазме ниже 10 мкЕД/мл. В генезе глюконеогенной реакции принимают участие также повышение содержания глюкагона в плазме и сохранение исходного уровня кортизола и гормона роста. Что касается механизма уменьшения концентрации инсулина в плазме, то главным стимулом для этого служит небольшое (на 150—200 мг/л) снижение содержания в ней глюкозы, которое обычно характеризует 24—72-часовое голодание. Однако отрицательный калорический баланс может и сам по себе обусловливать уменьшение секреции инсулина. Об этом свидетельствуют наблюдения, в которых инфузия небольших количеств глюкозы голодающим людям предотвращала снижение уровня сахара в крови, но не препятствовала развитию гипоинсулинемии [15]. Общие субстратно-гормональные нарушения, наблюдаемые при 14—72-часовом голодании, суммированы на рис. 11—2.
Если голодание продолжается в течение нескольких дней или недель, то включаются гомеостатические механизмы не только поддержания эугликемии, но и сохранения белковых запасов орга-

Рис. 11—2. Гормональные и субстратные изменения, поддерживающие-эугликемию (и предотвращающие гипогликемию) у здоровых лиц при голодании. Главным гормональным сдвигом является снижение уровня инсулина в плазме, что приводит к усилению продукции глюкозы и снижению ее утилизации. Уменьшение содержания инсулина в плазме в свою очередь обусловливается небольшим снижением уровня глюкозы в ней (на 50— 100 мг/л) и/или самим по себе уменьшением поступления калорий. низма. Значение последних механизмов иллюстрируется тем фактом, что смерть при голодании является следствием расходования от 1/3 до 1/2 белковой массы тела, что обусловливает слабость дыхательной мускулатуры, ателектазы, пневмонию и сепсис. Поскольку белок служит единственным источником неуглеводных предшественников глюконеогенеза (печень млекопитающих не может превращать в глюкозу жирные кислоты), снижение распада белка неминуемо приводит к уменьшению интенсивности глюконеогенеза. Несмотря на снижение продукции глюкозы, эугликемия и удовлетворение потребностей мозга в энергетических субстратах сохраняются потому, что при очень длительном голодании мозг окисляет в качестве альтернативного субстрата кетоновые тела [16]. Важнейшей детерминантой утилизации кетоновых тел мозгом является концентрация этих соединений в артериальной крови. Точный уровень кетокислот и продолжительность голодания, при которых начинается утилизация кетоновых тел мозгом, неизвестны, но ата продолжительность наверное превышает 3 сут и, вероятно, меньше 14 сут.
|
|
|


