 |
1.1 Первое начало термодинамики
|
|
|
|
1. 1 Первое начало термодинамики
Первое начало термодинамики представляет собой одну из формулировок закона сохранения энергии. Для бесконечно малого процесса его можно представить в виде

| (1. 2) |
где Q – теплота процесса; U – внутренняя энергия системы; W – работа, совершаемая системой или над системой в термодинамическом процессе.
Понятия теплоты и работы применимы только к процессам, но не к состоянию системы. Теплота и работа являются функциями процесса, их изменение зависит от пути протекания процесса. Поэтому бесконечно малые величины теплоты и работы не обладают свойствами дифференциала и для их обозначения используют греческую букву δ. Внутренняя энергия, напротив, является функцией состояния, поэтому для обозначения её бесконечно малого изменения используется знак дифференциала d.
Для конечного процесса первое начало термодинамики записывают:

| (1. 3) |
Согласно первому началу термодинамики, теплота, подведенная к закрытой системе, расходуется на увеличение ее внутренней энергии и совершение работы.
В термодинамике используют следующую систему знаков. Положительной считают теплоту, подведенную к системе, а отрицательной – отведенную от нее. Работу, совершенную системой, считают положительной, а совершаемую над системой, например, работу сжатия – отрицательной.
Работа расширения идеального газа
Рассмотрим работу расширения газов, которое происходит во многих химико-технологических процессах. В общем случае работа расширении газа в бесконечно малом процессе равна
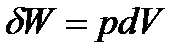
| (1. 4) |
Для реального конечного процесса расширения газа
|
|
|

| (1. 5) |
При не очень высоких давлениях (p < 10 атм) свойства газов близки к свойствам идеального газа. Поэтому для вычисления работы расширения будем использовать уравнение состояния идеального газа Менделеева-Клапейрона.
Работа расширения как функция процесса зависит от условий, в которых протекает процесс.
Изохорный процесс (V = const )
Если процесс протекает при постоянном объеме системы, то изменение объема dV = 0,

| (1. 6) |
Изотермический процесс (T =const )
Из уравнения Менделеева-Клапейрона (1. 1)
 ,
,
тогда при T = const

| (1. 7) |
Изобарный процесс (p = const)
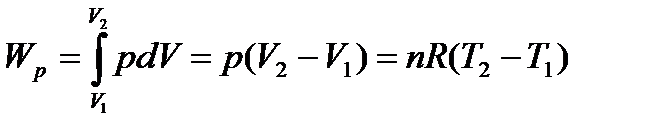
| (1. 8) |
Изобарно-изотермический процесс (p = const иT = const):
Из уравнения Менделеева-Клапейрона (1. 1)

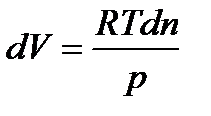
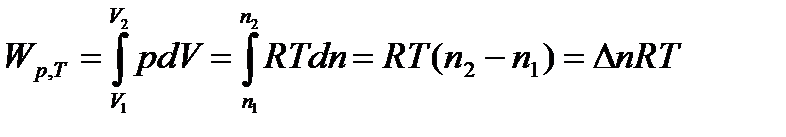
| (1. 9) |
Таким образом, в изобарно-изотермических условиях работа расширения может совершаться только за счет изменения числа молей газа.
Теплота процесса в различных условиях
Изохорный процесс (V = const)
Работа изохорного процесса W = 0. Тогда, как следует из первого начала термодинамики, теплота процесса в изохорных условиях QV равна изменению внутренней энергии:

Так как внутренняя энергия является функцией состояния, то в изохорных условиях теплота

| (1. 10) |
приобретает свойства функции состояния.
Изотермический процесс (T =const)
По закону Гей-Люсака-Джоуля внутренняя энергия идеального газа зависит только от температуры и не зависит от объема и давления. Следовательно, в изотермическом процессе не происходит изменения внутренней энергии (Δ U = 0). Тогда из первого начала термодинамики следует

| (1. 11) |
Таким образом, вся теплота в изотермическом процессе идет на совершение работы, Работа изотермического процесса совершается за счет подведенной теплоты.
|
|
|


