 |
1.10 Многовариантное задание №2 «Расчет равновесных парциальных давлений гетерогенной химической реакции»
|
|
|
|
1. 10 Многовариантное задание №2 «Расчет равновесных парциальных давлений гетерогенной химической реакции»
1. Определите константу равновесия Ka химической реакции В при температуре T с использованием средних изобарных теплоемкостей.
2. Запишите в общем виде выражение для константы равновесия химической реакции B через парциальные давления реагирующих веществ.
3. Определите парциальные давления газообразных веществ при температуре T и атмосферном давлении.
4. Оцените влияние изменения общего давления, температуры и разбавления реакционной смеси газом, не участвующим в химической реакции, на положение равновесия реакции и равновесный выход продукта.
Таблица 1. 3 – Варианты заданий
| Температура Т, К | |||||||
| Вар. | Химическая реакция B | Подвариант | |||||
| Fe + CO2 = FeO + CO | |||||||
| CO + H2 = C(графит) + H2O | |||||||
| Fe2O3 + 3CO = 2Fe + 3CO2 | |||||||
| C(графит) + CO2 = 2CO | |||||||
| Fe2O3 + H2 = 2FeO + H2O | |||||||
| FeO + H2 = Fe + H2O | |||||||
| Fe3O4 + H2 = 3FeO + H2O | |||||||
| Fe3O4 + 4H2 = 3Fe + 4H2O | |||||||
| Cr2O3 + 3CO = 2Cr + 3CO2 | |||||||
| 2ZnO + 2SO2= 2ZnS + 3O2 | |||||||
| Fe2O3 + 3H2 = 2Fe + 3H2O | |||||||
| 2SnS(α )+ 3O2 = 2SnO + 2SO2 | |||||||
| Mn3O4 + H2 = 3MnO + H2O | |||||||
| 2PbO(желт. ) + 2SO2 = 2PbS + 3O2 | |||||||
| MnO2 + 2CO = Mn + 2CO2 | |||||||
| 3MnO + CO2 = Mn3O4 + CO | |||||||
| 3Fe2O3 + CO = 2Fe3O4 + CO2 | |||||||
| WO3 + 3H2 = W + 3H2O | |||||||
| Fe2O3 + CO = 2FeO + CO2 | |||||||
| CO2 = C(графит) + O2 | |||||||
| 2C(графит) + O2 = 2CO | |||||||
| Sb2O3 + 3H2 = 2Sb + 3H2O | |||||||
| CO + H2 = C(графит) + H2O | |||||||
| PbS + 2O2 = PbO2 + SO2 | |||||||
| PbO2 + CO = PbO(желт. ) + CO2 | |||||||
| Mn2O3 + CO = 2MnO + CO2 | |||||||
1. 11 Контрольные вопросы
|
|
|
1. По изменению каких термодинамических функций рассчитывается тепловой эффект химической реакции, протекающей в изобарных или изохорных условиях?
2. Как формулируется закон Гесса?
3. Какие следствия из закона Гесса Вы знаете?
4. Что называется стандартной теплотой образования вещества?
5. Как рассчитывается тепловой эффект реакции с использованием теплот образования?
6. Как рассчитывается тепловой эффект реакции с использованием теплот сгорания?
7. Что называется стандартной теплотой сгорания вещества?
8. Что такое истинная и средняя молярная изобарная теплоемкость?
9. Как формулируется закон Кирхгоффа в дифференциальной и интегральной форме?
10. Как зависит тепловой эффект химической реакции от температуры? Ответ подтвердите соответствующим уравнением.
11. Почему в справочниках приводятся абсолютные значения энтропии веществ, а абсолютные значения энтальпии – нет?
12. Какие критерии направления процессов в изолированных и закрытых системах Вы знаете?
13. Что является критерием равновесия в закрытых системах?
14. Что такое термодинамические и практические константы равновесия химических реакций? Приведите примеры.
15. С помощью какого уравнения рассчитываются термодинамические константы равновесия?
16. Что такое химическая переменная (глубина превращения в химической реакции)?
Как эта величина используется для расчета равновесного состава в химическом процессе?
17. Что такое степень превращения исходных веществ в химической реакции?
18. Как влияет температура на равновесный выход продукта химической реакции? Ответ подтвердите соответствующим уравнением.
19. Как влияет давление на равновесный выход продукта химической реакции? Ответ подтвердите соответствующим уравнением.
|
|
|
20. В чем особенность расчета равновесного состава газовой смеси в гетерогенной реакции?
2 ФАЗОВЫЕ РАВНОВЕСИЯ
Основными понятиями в теории фазовых равновесий являются: система, фаза, компоненты, термодинамические степени свободы, вариантность системы.
Фаза – совокупность однородных частей системы, отделенная от других частей системы границей (поверхностью) раздела и имеющая в каждой точке одинаковые химические и физические свойства. Фаза характеризуется уравнением состояния.
Гомогенная система – однородная система, состоящая из одной фазы.
Гетерогенная система – неоднородная система, состоящая из нескольких фаз.
Составляющие вещества – вещества, которые могут быть выделены из системы и вне нее могут устойчиво существовать.
Компоненты системы – составляющие вещества, наименьшее число которых достаточно для образования системы.
Если в системе не происходит химических взаимодействий, то число компонентов равно числу составляющих веществ. А если в системе происходит химическое взаимодействие, то число компонентов меньше числа составляющих веществ на число уравнений, связывающих концентрации этих веществ.
Термодинамические степени свободы – число параметров, определяющих состояние системы, которые можно менять произвольно и независимо друг от друга, не вызывая при этом изменения числа и природы фаз в системе. В качестве таких параметров, как правило, выбирают давление, температуру и концентрации.
Вариантность системы – число термодинамических степеней свободы.
Условием равновесия в системе в изобарно-изотермических условиях (при p = const и T = const) является выполнение следующих равенств:

или
 , ,
| (2. 1) |
где k – число компонентов в системе.
Если в равновесии находятся две фазы
 ,
,
то
 , ,
| (2. 2) |
откуда
 , ,
| (2. 3) |
В многофазной гетерогенной системе условием равновесного существования фаз является равенство химических потенциалов для каждого i-го компонента во всех фазах:
 , ,
| (2. 4) |
где f – число фаз в системе.
Правило фаз Гиббса, которое называют также основным законом фазовых равновесий, устанавливает связь между числом компонентов k, числом фаз f и числом термодинамических степеней свободы (вариантностью) s и выражается уравнением:
|
|
|
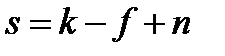 , ,
| (2. 5) |
где n – число параметров (температура и давление), определяющих состояние системы.
Если, кроме концентраций, параметрами, определяющими состояние системы, являются только давление и температура, то n = 2. В частных случаях, когда один из параметров поддерживается неизменным, например, давление (в изобарных условиях) или температура (в изотермических условиях), n = 1. В изобарно-изотермических условиях (когда p = const и T = const) n = 0.
Если в равновесной системе число термодинамических степеней свободы s = 2, то она называется бивариантной. Это означает, что произвольным образом и независимо друг от друга, не вызывая изменения фазового состава системы можно менять два параметра состояния. Когда s = 1, система называется моновариантной и произвольным образом можно изменять только один параметр. При s = 0 ни один из параметров состояния не может изменяться, не вызывая изменения фазового состава. В этом случае систему называют нонвариантной или безвариантной.
|
|
|


