 |
Изобарный процесс (p = const). 1.2 Расчет тепловых эффектов химических реакций
|
|
|
|
Изобарный процесс (p = const)
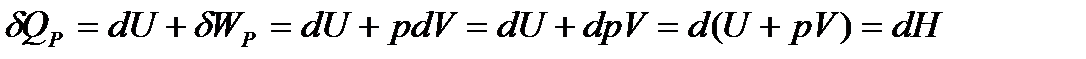
| (1. 12) |
или для конечного процесса

| (1. 13) |
Функция H = U + pV называется энтальпией.
Энтальпия, как и внутренняя энергия, является функцией состояния, поэтому в изобарных условиях теплота QPприобретает свойства функции состояния.
Изохорный и изобарный тепловые эффекты связаны соотношением

| (1. 14) |
Методы расчета и измерения тепловых эффектов химических реакций рассматриваются в разделе физической химии – термохимии. Рассмотрим практически важные из них.
Закон Гесса является основным законом термохимии. Он гласит:
Тепловой эффект процесса не зависит от пути его протекания (промежуточных стадий), а определяется начальным и конечным состоянием системы при условии, что давление и температура или объем системы и температура в ходе всего процесса остаются постоянными.
Закон Гесса позволяет рассчитывать тепловые эффекты реакций, если известны тепловые эффекты других реакций с участием тех же веществ. Из закона Гесса следует два важных следствия:
1. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ (с учетом стехиометрических коэффициентов).
Теплотой образования вещества называется тепловой эффект реакции образования одного моля вещества из простых веществ. Простым веществом называется химическое соединение, состоящее из атомов одного элемента, в наиболее устойчивой модификации при данных условиях. В изобарных условиях теплота образования (энтальпия образования) обозначается Δ fH (f – сокращение от английского слова formation – образование). Значения теплот образования при стандартных условиях  для большого количества веществ приведены в таблицах стандартных термодинамических величин в справочниках (см., например, [2]). Стандартные условия – нормальное атмосферное давление 101320 Па (1 атм или 760 мм рт. ст. ). Для термодинамических функций, стандартные условия указываются надстрочным индексом “0”. Например, H0.
для большого количества веществ приведены в таблицах стандартных термодинамических величин в справочниках (см., например, [2]). Стандартные условия – нормальное атмосферное давление 101320 Па (1 атм или 760 мм рт. ст. ). Для термодинамических функций, стандартные условия указываются надстрочным индексом “0”. Например, H0.
|
|
|
2. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции (с учетом стехиометрических коэффициентов).
Теплотой сгорания вещества Δ cH (c – сокращение от английского слова combustion – горение) называется тепловой эффект реакции сгорания одного моля вещества в избытке кислорода до CO2, H2O(ж. ), N2, SO2 и галогеноводородов. Стандартные теплоты сгорания  можно найти в справочниках, однако, они приведены для значительно меньшего количества веществ (в основном органических), чем теплоты образования.
можно найти в справочниках, однако, они приведены для значительно меньшего количества веществ (в основном органических), чем теплоты образования.
1. 2 Расчет тепловых эффектов химических реакций
В стандартных условиях тепловой эффект химической  может быть рассчитан по справочным значениям теплот образования
может быть рассчитан по справочным значениям теплот образования  :
:
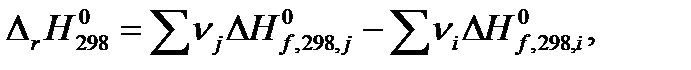
| (1. 15) |
здесь и далее индексы i относятся к исходным веществам или реагентам, а индексы j – к конечным веществам или продуктам реакции;  и
и  – стехиометрические коэффициенты в уравнении реакции для исходных веществ и продуктов реакции, соответственно.
– стехиометрические коэффициенты в уравнении реакции для исходных веществ и продуктов реакции, соответственно.
Пример: Рассчитаем тепловой эффект реакции синтеза метанола при стандартных условиях.
Решение: Для расчетов воспользуемся справочными данными по стандартным теплотам образования, участвующих в реакции веществ (см. табл. 44 на стр. 72 справочника [2]).
| Реакция | СО(Г. ) | + 2 Н2 (г. ) | = СН3ОН(г. ) |
Теплоты
образования  , кДж/моль , кДж/моль
| – 110, 53 | – 201, 00 |
Тепловой эффект реакции синтеза метанола в стандартных условиях по первому следствию из закона Гесса (уравнение 1. 15) равен:

|
|
|
При расчете тепловых эффектов химических реакции нужно учитывать, что тепловой эффект зависит от агрегатного состояния реагентов и от вида записи химического уравнения реакции:
| Реакция | Тепловой эффект в стандартных условиях |
| СО(г. ) + 2 Н2 (г. ) = СН3ОН(г. ) |
 = – 90, 47 кДж = – 90, 47 кДж
|
| СО(г. ) + 2 Н2 (г. ) = СН3ОН(ж. ) |  = – 128, 04 кДж = – 128, 04 кДж
|
| 0, 5 СО(г. ) + Н2 (г. ) = 0. 5 СН3ОН(ж. ) |  = – 64, 02 кДж = – 64, 02 кДж
|
По второму следствию из закона Гесса тепловой эффект можно рассчитать, используя теплоты сгорания Δ cH, как разность сумм теплот сгорания исходных веществ и продуктов реакции (с учетом стехиометрических коэффициентов):
 , ,
| (1. 16) |
Большинство химических реакций в химико-технологических системах ведут при повышенных температурах, чтобы повысить скорость реакций и, следовательно, повысить производительность системы. Для того чтобы рассчитать тепловой эффект химической реакции при любой температуре надо знать вид зависимости теплового эффекта от температуры Δ rH = f(T). Эта зависимость выражается законом Кирхгофа. В дифференциальной форме закон Кирхгофа имеет вид:
 , ,
| (1. 17) |
где Δ rCp – характеризует изменение изобарной теплоемкости системы в результате протекания химической реакции и называется температурным коэффициентом теплового эффекта реакции.
Из дифференциального уравнения Кирхгоффа следует, что зависимость теплового эффекта от температуры определяется знаком Δ rCp, т. е. зависит от того, что больше, суммарная теплоемкость исходных веществ или суммарная теплоемкость продуктов реакции. Проанализируем дифференциальное уравнение Кирхгофа.
1. Если температурный коэффициент Δ rC p > 0, то производная  > 0 и функция
> 0 и функция  возрастающая. Следовательно, тепловой эффект реакции с ростом температуры увеличивается.
возрастающая. Следовательно, тепловой эффект реакции с ростом температуры увеличивается.
2. Если температурный коэффициент Δ rCp < 0, то производная  < 0 и функция
< 0 и функция  убывающая. Следовательно, тепловой эффект реакции с ростом температуры уменьшается.
убывающая. Следовательно, тепловой эффект реакции с ростом температуры уменьшается.
3. Если температурный коэффициент Δ rCp = 0, то производная  = 0 и
= 0 и 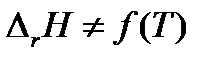 . Следовательно, тепловой эффект реакции не зависит от температуры. Этот случай на практике не встречается.
. Следовательно, тепловой эффект реакции не зависит от температуры. Этот случай на практике не встречается.
Дифференциальные уравнения удобны для анализа, но неудобны для расчетов. Чтобы получить уравнение для расчета теплового эффекта химической реакции, проинтегрируем дифференциальное уравнение Кирхгофа, разделив переменные:
|
|
|

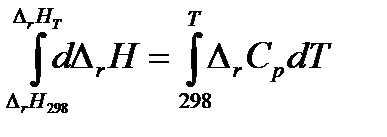

Теплоемкости веществ зависят от температуры, следовательно, и  . Однако, в области обычно используемых в химико-технологических процессах температурах эта зависимость не значительна. Для практических целей пользуются средними теплоемкостями веществ в интервале температур от 298 К до заданной температуры
. Однако, в области обычно используемых в химико-технологических процессах температурах эта зависимость не значительна. Для практических целей пользуются средними теплоемкостями веществ в интервале температур от 298 К до заданной температуры  , которые приводятся в справочниках. Температурный коэффициент теплового эффекта, рассчитанный с использованием средних теплоемкостей:
, которые приводятся в справочниках. Температурный коэффициент теплового эффекта, рассчитанный с использованием средних теплоемкостей:

| (1. 18) |
Тогда
 ,
,
откуда
 . .
| (1. 19) |
При стандартных условиях

| (1. 20) |
Пример: Рассчитаем тепловой эффект реакции синтеза метанола при температуре 1000 К и стандартном давлении.
Решение: Для расчетов воспользуемся справочными данными по средним теплоемкостям участвующих в реакции веществ в интервале температур от 298 К до 1000 К (см. табл. 40 на стр. 56 справочника [2]):
| Средние теплоемкости | СО(Г. ) | + 2 Н2 (г. ) | = СН3ОН(г. ) |
 , Дж/(моль∙ К) , Дж/(моль∙ К)
| 30, 92 | 29, 57 | 69, 21 |
Изменение средней теплоемкости системы в результате протекания химической реакции:

|
Тепловой эффект при 1000 К равен
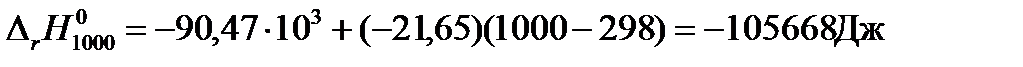 . .
|
|
|
|


