 |
I . Химическая термодинамика
|
|
|
|
Кафедра химии

УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
ПО ФИЗИЧЕСКОЙ ХИМИИ
Для студентов, обучающихся по специальности «Фармация»
ТВЕРЬ
2019
УДК 541.1
ББК 24
Авторы-составители: Бордина Г.Е., Лопина Н.П., Халяпина Я.М.
Под общей редакцией профессора, док.биол.наук. Г.М. Зубаревой
Рецензенты:
Е.А. Харитонова – канд. биол. наук, доцент кафедры биологии ГБОУ ВПО Тверская ГМА
Ю.П. Игнатова – канд. мед. наук, доцент кафедры физиологии ГБОУ ВПО Тверская ГМА
Учебно-методическое пособие утверждено ЦКМС ТГМА
Учебно-методическое пособие по физической химии [Текст]: учебное пособие для студентов фармацевтического факультета / Бордина Г.Е., Лопина Н.П. Халяпина Я.М. // Под общей редакцией: доктора биологических наук, профессора Г.М. Зубаревой. – Тверь, 2012. – 119 с.
Авторы-составители – сотрудники кафедры химии и биохимии Тверской государственной медицинской академии:
Галина Евгеньевна Бордина – канд. биол. наук, доцент кафедры химии
Надежда Петровна Лопина –канд. хим. наук, доцент кафедры химии
Янина Михайловна Халяпина – старший преподаватель кафедры химии
Учебно-методическое пособие составлено коллективом кафедры химии и биохимии Тверской государственной медицинской академии и предназначено в помощь студентам фармацевтического факультета для подготовки к лабораторно-практическим занятиям и экзамену.
УДК 541.1
ББК 24
© Бордина Г.Е., Лопина Н.П., Халяпина Я.М., 2012
ОГЛАВЛЕНИЕ
Предисловие………………………………………………………………...4
I. Химическая термодинамика…………………………………………... 5 – 6
Занятие № 1 Химическая термодинамика. Первое начало термодинамики………………………………………………………………7 – 16
|
|
|
Занятие № 2 Химическая термодинамика. Второе начало термодинамики.……………………………………………………………..17 – 27
Занятие № 3 Химический потенциал. Термодинамика
химического равновесия. Уравнение изотермы
химической реакции………………………………………………………..28 – 37
Занятие № 4 Итоговое занятие по теме «Химическая
термодинамика»………………………………..………………………38 – 39
II. Термодинамика фазовых равновесий……………………………….40
Занятие № 5 Термодинамика фазовых равновесий.
Основные понятия. Правило фаз Гиббса. Диаграммы состояния однокомпонентных систем………………………………………………...41 – 50
Занятие № 6 – 7 Закон Рауля. Диаграммы состояния
бинарных систем. Первый и второй законы Коновалова.
Простая и фракционная перегонка.……………………………………….51 – 63
Занятие № 8 Итоговое занятие по теме «Термодинамика
фазовых равновесий»………………………………………………………64 – 73
III. Термодинамика растворов электролитов.
Термодинамика разбавленных растворов.
Электрохимия……………………………………………………………..74
Занятие № 9 Буферные системы и растворы………..…………………...75 – 83
Занятие № 10 Буферные системы и растворы …………...……………...84 – 87
Занятие № 11 Теория растворов сильных электролитов.
Электрохимия………………………………………….…………………...88 – 93
Занятие № 12 – 13 Электрохимия …………………………......................94 – 108
Занятие № 14 Итоговое занятие по теме «Термодинамика растворов электролитов. Термодинамика разбавленных растворов.
Электрохимия» …………………………………………………………….109 – 110
Литература ………………………………………………………………...113
Приложение 1 ……………………………………………............................114 – 116
Приложение 2 ……………………………………………............................117
Приложение 3 ………………………………………………........................118
"Мощь и сила науки – во множестве фактов,
|
|
|
цель – в обобщении этого множества".
Д.И. Менделеев
ПРЕДИСЛОВИЕ
Настоящее учебно-методическое пособие соответствует примерной программе по дисциплине «Физическая и коллоидная химии» для специальности 060301 –фармация, утвержденной Руководителем Департамента образовательных медицинских учреждений и кадровой политики Минздрава России Н.Н. Володиным (Москва, 2002 г.).
Физическая химия является теоретической основой для изучения биохимии, фармацевтической химии, технологии лекарств, токсикологической химии, физиологии, физико-химических методов исследования и анализа, используемых в фармации.
Авторы-составители стремились подобрать задания, охватывающие все теоретические вопросы программы курса физической и коллоидной химии.
Новизна учебно-методического пособия заключается в том, что задания выбраны применительно не к отдельному понятию или закону, а к комплексу знаний.
Учебно-методическое пособие включает 3 модуля. Каждый модуль содержит вопросы к занятию, эталоны решения типовых и ситуационных задач, задачи для самостоятельного решения, тестовые задания с эталонами ответов.
Расчетные задачи сгруппированы по модульному принципу, что соответствует содержанию важнейших тем курса физической и коллоидной химии для медицинских вузов. В каждом модуле даны примеры решения типовых и ситуационных задач. На некоторые задачи ответы не приводятся; авторы-составители пошли на такой шаг вполне сознательно, так как в ряде случаев приведение ответа фактически означает сообщение студенту решения задачи.
Учебно-методическое пособие выполняет обучающую, контролирующую и прикладную функции, дает возможность студенту самому оценить уровень сформированности расчетных умений, развить собственную инициативу и познавательную активность по решению разнообразных химических задач.
Мы заранее благодарны всем коллегам, которые, ознакомившись с данным пособием, сообщат нам о замеченных ими просчетах или недостатках.
Авторы-составители
I. Химическая термодинамика
Учебные элементы модуля
| Тепловой эффект реакции в стандартных условиях по ΔН0обр. |  ΔН0обр. - стандартная теплота (энтальпия) образования конечных и исходных веществ
n – стехиометрический коэффициент
ΔН0обр. - стандартная теплота (энтальпия) образования конечных и исходных веществ
n – стехиометрический коэффициент
|
| Тепловой эффект реакции в стандартных условиях по ΔН0сгор. | 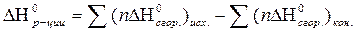 ΔН0сгор. - стандартная теплота (энтальпия) сгорания конечных и исходных веществ
n – стехиометрический коэффициент
ΔН0сгор. - стандартная теплота (энтальпия) сгорания конечных и исходных веществ
n – стехиометрический коэффициент
|
| Тепловой эффект реакции в стандартных условиях для реакции образования органического соединения из простых веществ | 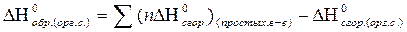 ΔН0сгор. - стандартная теплота (энтальпия) сгорания простых веществ и органического соединения
n – стехиометрический коэффициент
ΔН0сгор. - стандартная теплота (энтальпия) сгорания простых веществ и органического соединения
n – стехиометрический коэффициент
|
| Изменение молярных изобарных теплоемкостей |  С – молярные теплоемкости продуктов реакции и исходных веществ
n – стехиометрический коэффициент
С – молярные теплоемкости продуктов реакции и исходных веществ
n – стехиометрический коэффициент
|
| Тепловой эффект реакции при заданной температуре | 
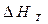 - тепловой эффект реакции при заданной температуре T - тепловой эффект реакции при заданной температуре T
 - тепловой эффект реакции при температуре T1 - тепловой эффект реакции при температуре T1
 - разность сумм молярных изобарных теплоемкостей продуктов реакции и исходных веществ - разность сумм молярных изобарных теплоемкостей продуктов реакции и исходных веществ
|
| Изменение энтропии реакции в стандартных условиях |  S0 - энтропия конечных и исходных веществ
n – стехиометрический коэффициент
S0 - энтропия конечных и исходных веществ
n – стехиометрический коэффициент
|
| Изменение энергии Гиббса в стандартных условиях |  D G0обр. - стандартную энергию Гиббса образования конечных и исходных веществ
n – стехиометрический коэффициент
D G0обр. - стандартную энергию Гиббса образования конечных и исходных веществ
n – стехиометрический коэффициент
|
| Изменение энергии Гиббса в нестандартных условиях |  ΔН0 - тепловой эффект реакции в стандартных условиях
ΔS0 - изменение энтропии реакции в стандартных условиях
Т – абсолютная температура
ΔН0 - тепловой эффект реакции в стандартных условиях
ΔS0 - изменение энтропии реакции в стандартных условиях
Т – абсолютная температура
|
| Выражение изменения стандартной энергии Гиббса через константу равновесия | ΔG 0 р-ции = - RT lnKp Кр - константы химического равновесия R - универсальная газовая постоянная Т – абсолютная температура |
| Уравнением изотермы химической реакции | ΔG р-ции = RT ln 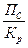 ПС - стехиометрическим соотношением концентраций веществ, участвующих в реакции
Кр - константы химического равновесия
R - универсальная газовая постоянная
Т – абсолютная температура
ПС - стехиометрическим соотношением концентраций веществ, участвующих в реакции
Кр - константы химического равновесия
R - универсальная газовая постоянная
Т – абсолютная температура
|
| Дифферен-циальная форма изобары химической реакции |  Кр - константы химического равновесия
ΔН0 - тепловой эффект реакции в стандартных условиях
R - универсальная газовая постоянная
Т – абсолютная температура
Кр - константы химического равновесия
ΔН0 - тепловой эффект реакции в стандартных условиях
R - универсальная газовая постоянная
Т – абсолютная температура
|
| Интегральная форма изобары химической реакции | ln  К1 - константы химического равновесия при Т1
К2 - константы химического равновесия при Т2
ΔН0 - тепловой эффект реакции в стандартных условиях
R - универсальная газовая постоянная
Т – абсолютная температура
К1 - константы химического равновесия при Т1
К2 - константы химического равновесия при Т2
ΔН0 - тепловой эффект реакции в стандартных условиях
R - универсальная газовая постоянная
Т – абсолютная температура
|
|
|
|
|
|
|
Занятие № 1
|
|
|


