 |
Химическая термодинамика. Первое начало термодинамики
|
|
|
|
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Лабораторная работа № 1
5. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Физическая химия – определение, предмет изучения.
2. Основные понятия термодинамики:
Ø система, термодинамическая система;
Ø системы: изолированные, закрытые и открытые (примеры);
Ø состояние системы - определение;
Ø процесс – определение;
Ø процессы: изотермические, изобарические, изохорические, адиабатические;
Ø функция состояния: внутренняя энергия, энтальпия, энтропия, энергия Гиббса.
3. 1-й закон термодинамики. Определение, математическое выражение 1-го закона для различных процессов.
4. Энтальпия. Функция состояния изобарного процесса.
5. Стандартная энтальпия образования и сгорания вещества, калорийность.
6. Закон Гесса. Следствия закона Гесса, их математическое выражение. Расчет стандартной теплоты химических реакций по стандартным теплотам образования и сгорания веществ.
7. Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгофа.
8. Тепловые эффекты реакций. Термохимический и термодинамический способ записи химических уравнений.
9. Теплоемкость – удельная, молярная, истинная, средняя.
10. Теплота растворения, теплота нейтрализации, теплота фазовых переходов.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 21 – 47 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 19 – 22 c.
Эталоны решения типовых задач
|
|
|
Расчет стандартной энтальпии химической реакции по стандартным энтальпиям образования и сгорания веществ.
Задача 1
Рассчитайте, пользуясь первым следствием из закона Гесса, тепловой эффект реакции окисления сахарозы в организме человека, который описывается уравнением:

и удельную калорийность сахарозы.
Решение:
Из справочных данных (см. приложение 1):




По 1 следствию из закона Гесса:


Молярная масса сахарозы М(C12H22O11)=342 г/моль, поэтому удельная калорийность сахарозы равна 5645,4:342=16,5 кДж/г.
Ответ: - 5645,4 кДж/моль; 16,5 кДж/г.
Задача 2
Определите тепловой эффект реакции синтеза акриловой кислоты при 298 К:
CH  CH (г) + СO (г) + H2O (ж)
CH (г) + СO (г) + H2O (ж) 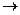 CH2 = CH- COOH (ж), если известны стандартные теплоты сгорания веществ, участвующих в химической реакции:
CH2 = CH- COOH (ж), если известны стандартные теплоты сгорания веществ, участвующих в химической реакции:




Решение:
По 2 следствию из закона Гесса:


Ответ: 352,9 кДж
Задача 3
Определите стандартную теплоту образования этилового спирта, если теплоты сгорания углерода, водорода и этилового спирта соответственно равны:
-393,5; -285,8; -1366 кДж/моль.
Решение:
Образование этилового спирта из простых веществ можно представить так:
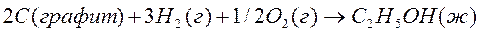
Теплота сгорания кислорода равна нулю.
По 3 следствию из закона Гесса:


Ответ: - 278,4 кДж/моль
Расчет теплового эффекта реакции при температуре, отличающейся от 25ºС. Зависимость теплового эффекта от температуры (уравнение Кирхгофа).
Задача 4
Рассчитать тепловой эффект реакции синтеза метанола из водорода и оксида углерода на твердом катализаторе при 500 К. Как изменится тепловой эффект при повышении температуры от 298 К до 500 К.
Решение:
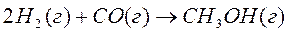
0 -110,53 -201,0  кДж/моль
кДж/моль
28,83 29,14 44,13  Дж/моль•К
Дж/моль•К
Решение:

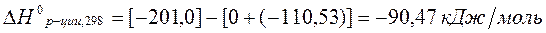


Рассчитаем  по уравнению Кирхгоффа:
по уравнению Кирхгоффа:

 С ростом температуры количество выделяющегося тепла растет, т.к.
С ростом температуры количество выделяющегося тепла растет, т.к. 
Задачи для самостоятельной работы
|
|
|
1. Теплоты образования NO (г) и NO2 (г), равны соответственно, 91,26 и 34,19 кДж/моль. Вычислите тепловой эффект реакции
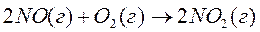 в кДж
в кДж
2. Исходя из стандартной теплоты образования углекислого газа (г), равной –393,51 кДж/моль и термохимического уравнения:

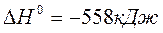 ,
,
вычислите стандартную теплоту образования N2O (г) в кДж/моль.
3. Рассчитайте 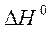 в кДж реакции сгорания аммиака по уравнению:
в кДж реакции сгорания аммиака по уравнению:

если стандартные энтальпии образования NH3(г) и H2O (ж) равны – 45,94 и - 285,83 кДж/моль, соответственно.
4. Вычислите стандартную теплоту образования бензойной кислоты C6H5COOH (к) в кДж/моль, если ее стандартная теплота сгорания по уравнению

равна –3228 кДж/моль, а стандартные теплоты образования H2O (ж) и CO2 (г) равны –285,83 и –393,51 кДж/моль, соответственно.
5. Горение формальдегида протекает по уравнению:


Вычислите стандартную теплоту образования формальдегида в кДж/моль, если стандартные теплоты образования углекислого газа и воды равны –393,51 и –241,81 кДж/моль, соответственно.
6. Стандартные теплоты сгорания ацетилена (г), этана (г) и водорода (г) равны, соответственно, -1300, -1540 и –286 кДж/моль. Вычислите тепловой эффект 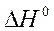 реакции в кДж:
реакции в кДж:

7. По стандартным теплотам сгорания веществ рассчитайте  реакции в кДж.
реакции в кДж.

 -1367 -874 -2254 0
-1367 -874 -2254 0
8. Стандартная теплота сгорания глюкозы (т) равна –2816 кДж/моль; этилового спирта (ж) –1236 кДж/моль. На основании этих данных вычислите тепловой эффект биохимического процесса брожения глюкозы в кДж, т.е.  реакции в стандартных условиях:
реакции в стандартных условиях:

9. Найти тепловой эффект реакции при T = 400 К (все участники реакции газообразные вещества).
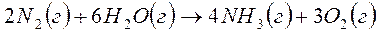
Справочные данные:
| Вещество |  кДж/моль кДж/моль
|  Дж/моль·К Дж/моль·К
|
| N2 | 0 | 29,12 |
| H2O | -241,81 | 33,61 |
| O2 | 0 | 29,37 |
| NH3 | -45,94 | 35,16 |
10. При получении синтез – газа из гексана основная реакция идет по уравнению:

Определите тепловой эффект реакции, если она протекает при температуре 1350оС.
Справочные данные:
| Вещество | 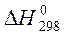 кДж/моль кДж/моль
|  Дж/моль·К Дж/моль·К
|
| C6H14(г) | -167,19 | 143,09 |
| O2 | 0 | 29,37 |
| CO(г) | -110,53 | 29,14 |
| H2(г) | 0 | 28,83 |
11. Рассчитать тепловой эффект химических реакций (см. таблицу) при 298 К и 500 К, используя средние значения теплоемкости  .
.
| № | Уравнение химической реакции |
| 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 | 2 H2 (г) + CO (г) → CH3OH (ж) 4 HCl (г) + O2 (г) → 2 H2O (г) + 2 Cl2 (г) 2 N2 (г) + 6 H2O (г) → 4 NH3 (г) + 3 O2 (г) 4 NO (г) + 6 H2O (г) → 4 NH3 (г) + 5 O2 (г) 2 NO2 (г) → 2 NO (г) + O2 (г) N2O4 (г) → 2 NO2 (г) CaCO3 (тв) → CaO (тв) + CO2 (г) Ca(OH)2 (тв) → CaO (тв) + H2O (г) ½ S2 (г) + 2 H2O (г) → SO2 (г) + 2 H2 (г) ½ S2 (г) + 2 CO2 (г) → SO2 (г) + 2 СО (г) SO2 (г) + Cl2 (г) → SO2Cl2 (г) CO (г) + 3 H2 (г) → CH4 (г) + H2O (г) 2 CO (г) + SO2 (г) → ½ S2 (г) + 2 СО2 (г) СО (г) + Cl2 (г) → СОCl2 (г) CO2 (г) + H2 (г) → CO (г) + H2O (г) 2 CO2 (г) → 2 CO (г) + O2 (г) |
|
|
|
Задания в тестовой форме
«ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
|
|
|


