 |
Химический потенциал. Термодинамика химического равновесия. Уравнение изотермы химической реакции.
|
|
|
|
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Что называют химическим потенциалом? Определение. Формула для расчета. Размерность.
2. Уравнение для расчета химического потенциала вещества, находящегося в растворе.
3. Стандартный химический потенциал. Физический смысл данной величины.
4. Термодинамика химического равновесия
5. Что называют стехиометрическим соотношением концентраций Пс?
6. Стандартное изменение энергии Гиббса, его связь с константой равновесия. Вывод формулы.
7. Закон действующих масс. Математическое выражение. Определение.
8. Уравнение изотермы химической реакции. Ее значение для термодинамических определений.
9. Влияние температуры на химическое равновесие.
10. Интегральная и дифференциальная формы изобары и изохоры химической реакции.
11. Термодинамическое обоснование принципа Ле – Шателье.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 69 – 74 с.
Эталоны решения типовых задач
Расчет константы равновесия по изменению стандартной энергии Гиббса. Выявление практической обратимости реакции в стандартном состоянии.
Задача 1
Рассчитайте константу химического равновесия реакции гидролиза глицил-глицина при 310 К, если ∆G0 = - 15,08 кДж/моль. Обратима ли практически данная реакция?
R = 8,31∙10-3 кДж/моль∙К
Решение:
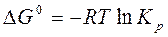
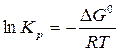
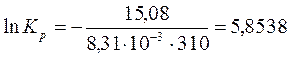
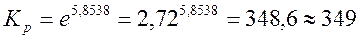
или

Ответ: 10-5 < 349 < 105 , т.е. реакция обратима.
Расчет по уравнению изотермы реакции. Определение направления обратимой реакции в состоянии, отличающемся от стандартного.
|
|
|
Задача 2
Для реакции СО (г) + Сl2 (г) → СОСl2 (г) константа равновесия равна 6,386 при 600ºС. В каком направлении она будет протекать, если в 1 л реакционной смеси будет находиться:
a) 1 моль СО; 1 моль Сl2; 4 моль СОСl2;
b) 1 моль СО; 1 моль Сl2; 8 моль СОСl2;
c) 1 моль СО; 1,565 моль Сl2; 10 моль СОСl2;
Решение:
При постоянном объеме концентрации газов пропорциональны их количествам, поэтому при расчете величины ПС, входящей в уравнение изотермы, подставляем количества веществ:
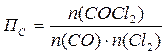
a) 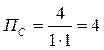
b) 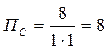
c) 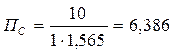
Ответ:
a) Самопроизвольно будет протекать прямая реакция, так как ПС < KP; 4 < 6,386
b) Самопроизвольно будет протекать обратная реакция, так как ПС > KP; 8 > 6,386
c) Система находится в состоянии равновесия так как ПС = KP; 6,386 = 6,386
Задача 3
Реакция образования иодида водорода  протекает в условиях Робщ.=2 атм.; исходные количества веществ: иода – 1 моль; водорода – 1 моль; иодоводорода – 2 моль; константа этой реакции при 4200С
протекает в условиях Робщ.=2 атм.; исходные количества веществ: иода – 1 моль; водорода – 1 моль; иодоводорода – 2 моль; константа этой реакции при 4200С  . В каком направлении будет протекать реакция в заданных условиях.
. В каком направлении будет протекать реакция в заданных условиях.
Решение:
Направление процесса в стандартных условиях можно определить по знаку 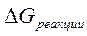 – изменению свободной энергии системы. Энергия Гиббса реакции
– изменению свободной энергии системы. Энергия Гиббса реакции 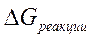 и константа равновесия связаны между собой уравнением изотермы химической реакции:
и константа равновесия связаны между собой уравнением изотермы химической реакции:

По закону Дальтона рассчитывают парциальные давления участников реакции:
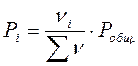
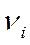 - число молей i – того компонента
- число молей i – того компонента
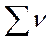 - общее число молей газообразных веществ в смеси.
- общее число молей газообразных веществ в смеси.


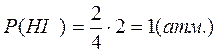
T = 420+273 = 693 K
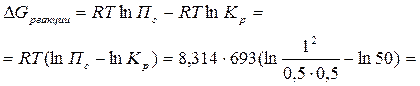
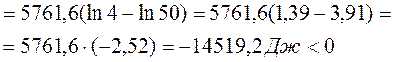
В данных условиях будет протекать процесс образования иодоводорода.
Расчет константы равновесия и стандартной энтальпии реакции по двум константам при разных температурах по уравнению изобары реакции.
Задача 4
Константы равновесия реакции:
Fe3O4 (тв) + 4СО (г) → 3Fe (тв) + 4СО2 (г)
При 1091 К и 1312 К равны 2,49 и 4,50 соответственно. Рассчитайте:
|
|
|
a) стандартную энтальпию реакции;
b) константу равновесия реакции при 1200 К.
Решение:
a) По уравнению изобары химической реакции при Т1 = 1091 К и Т2 = 1312 К рассчитываем ∆Н0.
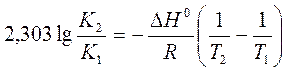
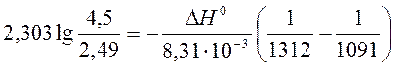
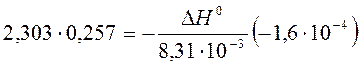
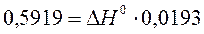
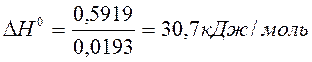
b) Пусть Т1 = 1091 К и Т3 = 1200 К.

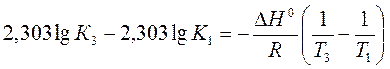
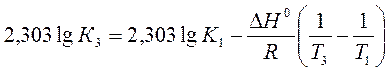
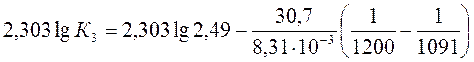
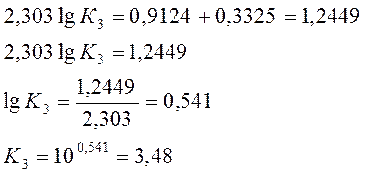
Ответ: a) ∆Н0 = 30,7 кДж/моль b) Кр 1200 = 3,48
|
|
|


