 |
Эталоны решения типовых задач
|
|
|
|
Расчет рН буферных систем по уравнению Гандерсона-Гассельбаха.
Задача 1
Найти рН буферной смеси, состоящей из 100 мл 0,1 н раствора CH3COOH и 10 мл 0,1 н раствора CH3COONa. КД (CH3COOH) = =1,8•10-5; lg 1,8•10-5 = - 4,74.
Решение:
По уравнению Гандерсона-Гассельбаха для кислотного буфера находим:


Ответ: pH = 3,74
Расчет буферной емкости.
Задача 2
Найти буферную емкость гидрокарбонатной буферной системы, если на титрование 15 мл ее потребовалось 12 мл 0,1 н раствора NaOH. Начальное значение рН = 5,2; конечное значение рН = 6,8.
Решение:
Используем формулу для расчета буферной емкости (при титровании щелочью)


Ответ: В = 5•10-2 моль/л
Расчет рН растворов протолитов, полученных смешением растворов разных веществ
Задача 3
Вычислите рН раствора, полученного смешением равных объемов растворов с (НСl) = 0,015 моль/л и с (NaOH) = 0,03 моль/л
Решение:
Запишем уравнение реакции:
HCl + NaOH → NaCl + H2O
По условию задачи раствор кислоты прореагировал полностью. Следовательно, после протекания реакции нейтрализации среда полученного раствора будет щелочной. Определим концентрацию NaOH после завершения реакции.
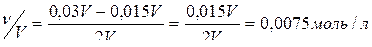

Ответ: рН = 11,9
Расчет объемов веществ для приготовления буферного раствора с заданными параметрами
Задача 4
Вычислите объемы растворов гидрофосфата натрия с концентрацией 0,1 моль/л и дигидрофосфата натрия с концентрацией 0,15 моль/л для приготовления буферного раствора объемом 1 л с рН = 7,0.
Решение:
Запишем протолитическое равновесие:
H2PO41- + H2O ↔ H3O+ + HPO42-
a1 b2 a2 b1
Найдем отношение концентраций солей в буферном растворе, который надо приготовить:
|
|
|

Где pKa (H2PO41-) = 7,21. Обозначим объем раствора гидрофосфата натрия через х (л), тогда объем раствора дигидрофосфата натрия (1-х) (л). Количества веществ этих солей в приготовленном растворе будут равны соответственно 0,1 х (моль) и 0,15 (1-х) (моль).
Поскольку эти количества веществ находятся в одном и том же объеме, отношение концентраций можно заменить отношением количеств веществ:



откуда х = 0,48 л, т.е. V(Na2HPO4) = 0,48 л; V(NaH2PO4) = 0,52 л.
Ответ: 480 мл раствора гидрофосфата натрия и 250 мл дигидрофосфата натрия.
Выявление буферных свойств раствора на основании анализа количеств веществ его компонентов.
Задача 5
Серия растворов приготовлена смешением двух растворов:
А) гидроксида натрия (с = 0,1 моль/л; V = 10 мл) и уксусной кислоты (с = 0,05 моль/л; V = 5 мл);
Б) гидроксида натрия (с = 0,05 моль/л; V = 5 мл) и уксусной кислоты (с = 0,1 моль/л; V = 10 мл);
В) ацетата натрия (с = 0,1 моль/л; V = 10 мл) и соляной кислоты (с = 0,05 моль/л; V = 5 мл);
Г) ацетата натрия (с = 0,1 моль/л; V = 10 мл) и уксусной кислоты (с = 0,01 моль/л; V = 5 мл);
Д) гидроксида натрия (с = 0,1 моль/л; V = 10 мл) и ацетата натрия (с = 0,01 моль/л; V = 5 мл);
Решение:
Только компоненты раствора Г) могут образовать буферную систему, т.е. протолитическую пару слабая кислота – сопряженное основание. В растворах А), Б), В) подобные пары могут образоваться в результате обменных реакций. Однако необходимо сделать расчет, так как в избытке может оказаться и слабый электролит (пара образуется), и сильный (пары не образуется). Раствор Д) не содержит компоненты, отвечающие данным условиям, и они не могут образоваться в результате реакции. Раствор Д) однозначно не обладает буферным действием.
Рассчитаем, какие компоненты останутся после протекания реакции в растворах А), Б), В). Для этого рассчитаем количества вступающих в реакции веществ (в ммоль).
А) ν (NaOH) = 0,1 • 10 = 1 ммоль и ν (CH3COOH) = 0,05 • 5 = 0,25 ммоль.
|
|
|
Поскольку кислота прореагирует полностью, то по окончании реакции в растворе останутся NaOH и CH3COOH; протолитическая пара не образуется.
Б) ν (NaOH) = 0,05 • 5 = 0,25 ммоль и ν (CH3COOH) = 0,1 • 10 = 1 ммоль.
Поскольку щелочь прореагирует полностью, то по окончании реакции в растворе будут CH3COOH (1 – 0,25 = 0,75 ммоль) и CH3COONa (0,25 ммоль); протолитическая пара образуется.
В) ν (CH3COONa) = 0,1 • 10 = 1 ммоль и ν (HCl) = 0,05 • 5 = 0,25 ммоль.
Поскольку кислота прореагирует полностью, то по окончании реакции в растворе будут CH3COOH (0,25 ммоль) и CH3COONa (1 – 0,25 = 0,75 ммоль); протолитическая пара образуется.
Для окончательного ответа на вопрос надо выяснить, отвечает ли соотношение компонентов в растворах Б), В), Г) зоне буферного действия:
Б)
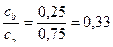
| В)

| Г)

|
Соотношение компонентов отвечает зоне буферного действия только в растворах Б) и В).
Ответ: буферным действием обладают растворы Б) и В).
|
|
|


