 |
Эталоны решения типовых задач
|
|
|
|
Задача 1
Лед плавится при Т = 273 К под давлением 101325 Па, удельный объем льда при этой температуре 991,1 см3/кг, а воды 916,6 см3/кг. Молярная теплота плавления льда 6010 Дж/моль. Вычислить давление при котором лед будет плавиться при 271 К.
Дано:
Т1 = 273 К
Р1 =101325 Па
Vуд.тв = 991,1 см3/кг
Vуд. ж = 916,6 см3/кг
∆Н = 6010 Дж/моль
Т2 = 271 К
 Р2 =?
Р2 =?
|  Решение:
1. Находим изменение объема при плавлении льда.
∆ V = Vж – Vтв = (916,6 – 991,1) =
= 74,5 см3/кг = - 74,5•10-6 м3/кг
2. Находим изменение молярного объема.
∆ Vмол = ∆ Vуд • М = - 74,5•10-6 • 18,0 •10-3 =
= - 1341•10-9 м3/моль = - 1,341•10-6 м3/моль
3. По уравнению Клайперона-Клаузиуса Решение:
1. Находим изменение объема при плавлении льда.
∆ V = Vж – Vтв = (916,6 – 991,1) =
= 74,5 см3/кг = - 74,5•10-6 м3/кг
2. Находим изменение молярного объема.
∆ Vмол = ∆ Vуд • М = - 74,5•10-6 • 18,0 •10-3 =
= - 1341•10-9 м3/моль = - 1,341•10-6 м3/моль
3. По уравнению Клайперона-Клаузиуса
|
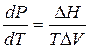



Для малого интервала температур можно принять

∆Р = Р2 – Р1 = - 16,42•106•∆Т
Р2 = Р1 – 16,42•106•∆T
P2 = 101325 – 16,42•106 • (271-273) = 1,01•105 + 32,84•106 = 329,41•105 ≈ 330•105
Таким образом при уменьшении температуры плавления на 2 К давление должно возрасти с 1,01•105 до 330•105.
Ответ: P2 = 330•105 Па
Задачи для самостоятельной работы
1. При нагревании ромбическая сера переходит в моноклинную. При этом изменение объема составляет ∆V = 1,38•10-5 м3/кг. Температура перехода равна 96,7º С, а ее изменение с давлением определяется коэффициентом 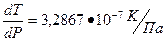 . Определить молярную теплоту фазового перехода (∆ Н в Дж/моль). Молярная масса серы равна 32 г/моль.
. Определить молярную теплоту фазового перехода (∆ Н в Дж/моль). Молярная масса серы равна 32 г/моль.
2. Рассчитать молярную теплоту плавления дифениламина, если плавление 1 кг дифениламина сопровождается увеличением объема на 9,58•10-5 м3/кг,  . Температура плавления дифениламина 54º С, молекулярная масса 169 г/моль.
. Температура плавления дифениламина 54º С, молекулярная масса 169 г/моль.
3. Давление паров диэтилового эфира при 20º С и 30º С соответственно равны 58945 и 866285 Па. Рассчитать теплоту испарения эфира в указанном интервале температур.
4. Давление пара этилового эфира при t = - 10º С равно 15300 Па, а при 0º С 24600 Па. Рассчитать молярную теплоту испарения эфира.
|
|
|
5. Давление паров бензола при температурах 15,4º С и 60,6º С равны соответственно 8 и 53,3 кПа. Определить молярную теплоту испарения бензола.
6. Рассчитать давление насыщенного пара воды при 25º С, если молярная теплота испарения воды 42,7 кДж/моль, температура кипения 100º С при нормальном давлении Р = 101325 Па.
Задания в тестовой форме
«ТЕРМОДИНАМИКА ФАЗОВЫХ РАВНОВЕСИЙ. ОСНОВНЫЕ ПОНЯТИЯ. ОДНОКОМПОНЕНТНЫЕ СИСТЕМЫ»
Задание: Укажите один или несколько вариантов правильных ответов
1. Совокупность гомогенных частей системы, имеющих одинаковые химические, физические и термодинамические характеристики называется
A. фазой
B. фазовым переходом
C. поверхностью раздела
2. Системы, у которых отдельные компоненты находятся в одной фазе и отсутствуют поверхности раздела называются
A. равновесными
B. гомогенными
C. стационарными
3. Примерами гетерогенной системы являются
A. этиловый спирт + вода
B. лед + вода
C. бензол + вода
4. Система является гетерогенной, если
A. Ф = 1
B. Ф = 2
C. Ф = 3
5. Переход вещества из одного агрегатного состояния в другое, а также изменение его аллотропной или полиморфной модификации называется
A. процессом
B. фазовым переходом
C. химическим явлением
6. Переход вещества из жидкого состояния в газообразное называется
A. испарением
B. сжижением
C. парообразованием
7. При нагревание металлический йод из твердого состояния переходит в газообразное, то есть происходит
A. испарение
B. сублимация
C. возгонка
8. При нагревании хлорида аммония происходит реакция
NH4Cl ↔ NH3 ↑ + HCl ↑.
Этот процесс называют
A. парообразованием
B. испарением
C. сублимацией
9. Явление, когда данный элемент способен существовать в виде различных простых веществ называется
|
|
|
A. вариантность
B. полиморфизмом
C. аллотропией
10. Если веществу в твердом состоянии соответствуют две, три или больше модификаций, различающиеся по внутреннему строению и свойствам, то это явление называют
A. аллотропией
B. полиморфизмом
C. изомерией
11. Чему равно число составляющих веществ в водном растворе поваренной соли
NaCl ↔ Na+ + Cl –
H2O ↔ H+ + OH –
A. трем
B. двум
C. четырем
12. Число составляющих веществ в водном растворе хлорида калия равно
КCl ↔ К+ + Cl –
H2O ↔ H+ + OH –
A. четырем
B. трем
C. двум
13. Число составляющих веществ в водном растворе этилового спирта равно
С2Н5ОН
H2O ↔ H+ + OH –
A. двум
B. трем
C. четырем
14. В водном растворе хлорида натрия число компонентов равно
A. четырем
B. трем
C. двум
15. Число составляющих веществ равно числу компонентов, если между ними
A. возможна одна химическая реакция
B. невозможны никакие химические реакции
C. возможны две химические реакции
16. Чему равно число независимых компонентов в растворе хлорида калия в условиях полной диссоциации? Ответ поясните.
A. 1
B. 2
C. 3
17. Сколько параметров (давление, температуру, концентрации) можно одновременно и произвольно менять, не изменяя числа фаз равновесной системы показывает
A. число степеней свободы
B. вариантность
C. количество степеней свободы
18. Число степеней свободы увеличивается с увеличением
A. числа компонентов
B. числа фаз
C. числа внешних параметров
19. Между числом степеней свободы (С), числом компонентов (К) и числом фаз (Ф) существует следующая зависимость
A. С = К + Ф +П
B. С = К – Ф + П
C. С = К + Ф – П
20. Системы, не имеющие ни одной степени свободы называются
A. нонвариантными
B. инвариантными
C. безвариантными
21. Если при изменении хотя бы одного из параметров равновесие системы смещается и одна из фаз исчезает, то такие системы называются
A. моновариантными
B. нонвариантными
C. безвариантными
22. Выберите правильное выражение для однокомпонентной системы, если число внешних параметров равно 2
A. С = 3 - Ф
B. С = 2 - Ф
C. С = 1 – Ф
23. Графическая зависимость состояния системы от внешних условий или от состава системы называется
|
|
|
A. диаграммой состава
B. диаграммой состояния
C. фазовой диаграммой
24. Может ли в однокомпонентной системе одновременно присутствовать больше трех фаз? Ответ поясните.
A. да
B. нет
C. не знаю
25. Чему равно число степеней свободы для точки Х, находящейся внутри области “тв”? Ответ поясните.
A. 1
B. 2
C. 3
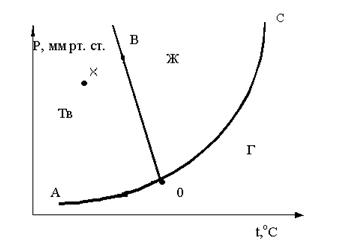
26. Если находясь в точке трехфазного состояния внешние условия системы изменить T↓, P = const то образуется
A. жидкая вода
B. лед
C. пар
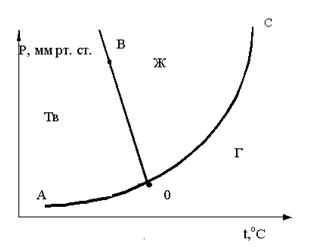
27. Чему равно число степеней свободы для точки K, находящейся на линии ОА? Ответ поясните.

A. 2
B. 3
C. 1
28. Исходя из графика определите, каким образом нужно изменить внешние условия, чтобы из точки трехфазного состояния системы перейти в область Ж

A. T↓, P = const
B. P↑, T = const
C. P↓, T = const
29. Выберите правильные координаты тройной точки на диаграмме состояния воды
A. t ≈ 0,1C° P = 4,6 мм. рт. ст.
B. t ≈ 0,01C° P ≈ 4,6 мм. рт. ст.
C. t ≈ 0,01C° P = 4,6 мм. рт. ст.
30. Чему равно число степеней свободы для точки Q на диаграмме состояния серы? Ответ поясните.

A. 2
B. 1
C. 0
31. Чему равно число степеней свободы для точки P на диаграмме состояния серы. Ответ поясните.

A. 2
B. 1
C. 0
32. Чему равно число степеней свободы для точки B на диаграмме состояния серы? Ответ поясните.
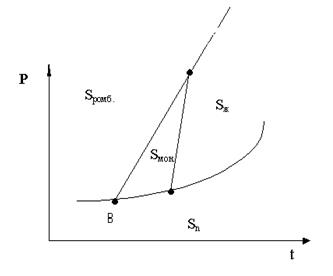
A. 1
B. 0
C. 2
33. Две модификации серы находятся в равновесии при температуре
A. 9,54ºС
B. 95,4°С
C. 25°С
34. Обратимые превращения модификаций называются
A. динамическими
B. аллотропными
C. энантиотропными
35. Если изменяют температуру то фазовое равновесие сохранится только при соответствующем изменении давления, и наоборот. Эту зависимость показывает
A. уравнение Гиббса
B. уравнение Менделеева-Клайперона
C. уравнение Клаузиуса-Клайперона
36. Уравнение Клаузиуса-Клайперона показывает зависимость между соответствующими изменениями
A. внутренней энергии и энтальпии
B. объема и температура
C. давления и температуры
Занятие № 6 - 7
|
|
|
|
|
|


