 |
Задачи для самостоятельной работы
|
|
|
|
1. Какой металл служит анодом, а какой катодом в:
а) медно - цинковом гальваническом элементе;
б) медно - никелевом гальваническом элементе;
в) медно - кобальтовом гальваническом элементе;
г) олово - цинковом гальваническом элементе;
д) серебряно - цинковом гальваническом элементе;
е) серебряно - кадмиевом гальваническом элементе;
ж) хромо - никелевом гальваническом элементе;
з) золото - никелевом гальваническом элементе?
2. Составьте схему:
а) олово - цинкового гальванического элемента;
б) железо - цинкового гальванического элемента;
в) медно - хромового гальванического элемента;
г) хромо - марганцевого гальванического элемента;
д) кобальт - марганцевого гальванического элемента;
е) кадмий - марганцевого гальванического элемента;
ж) олово - кадмиевого гальванического элемента?
3. Какие металлы следовало бы выбрать для изготовления гальванического элемента с максимальным значением ЭДС?
4. Из четырех металлов: Ag, Cu, Al и Sn выберите пару, которая обеспечит наибольшую ЭДС составленного из них гальванического элемента.
5. Возможно ли изготовить гальванический элемент с серебряными катодом и анодом? Ответ кратко аргументировать.
6. Возможно ли изготовление гальванического элемента, в котором и катодом, и анодом служила бы медь? Ответ кратко аргументировать.
7. Рассчитайте величину электродного потенциала водородного электрода, опущенного в раствор кислоты с рН = 1 (t = 25°C).
8. Каково значение  для водородного электрода, погруженного в раствор кислоты с рН = 2 (t = 25°C)?
для водородного электрода, погруженного в раствор кислоты с рН = 2 (t = 25°C)?
9. Рассчитайте значение  для водородного электрода, погруженного в раствор кислоты с рН = 3 (t = 25°C).
для водородного электрода, погруженного в раствор кислоты с рН = 3 (t = 25°C).
10. Принимая стандартный электродный потенциал водородного электрода равным нулю, рассчитайте значение потенциала водородного электрода, погруженного в чистую воду (t = 25°C).
|
|
|
11. Вычислите ЭДС медно-цинкового гальванического элемента, если концентрации растворов ZnSO4 и CuSO4 равны, соответственно, 0,01 и 1 моль/л (t = 25°C).
12. Вычислите ЭДС медно-цинкового гальванического элемента, если концентрации растворов ZnSO4 и CuSO4 равны, соответственно, 1 и 0,001 моль/л (t = 25°C).
13. Рассчитайте ЭДС медно-цинкового гальванического элемента, если концентрации растворов ZnSO4 и CuSO4 равны соответственно 0,001 и 1 моль/л (t = 25°C).
14. Рассчитайте ЭДС гальванического элемента, образованного цинковым электродом, опущенным в 0,1 M раствор нитрата цинка (II), и свинцовым электродом, опущенным в 2 М раствор нитрата свинца (II) (t = 25°C).
15. Рассчитайте ЭДС гальванического элемента, состоящего из серебряного и цинкового электродов, погруженных в растворы собственных солей; (t=25°C).

16. Рассчитайте ЭДС (в В при 25°С) концентрационного гальванического элемента, состоящего из серебряных электродов, опущенных в растворы AgNO3 с концентрациями: C1(Ag+) = 0,1 моль/л и C2(Ag+) = 0,01 моль/л; 
17. Электродный потенциал водородного электрода, опущенного в желудочный сок с неизвестной концентрацией водородных ионов, равен - 0,059 В. Рассчитайте рН и Сн+ желудочного сока в моль/л; t=25°C.
18. Потенциал водородного электрода, опущенного в слюну, оказался равным - 0,295 В. Рассчитайте рН слюны и определите, отвечает ли он норме (в норме рН слюны 6,35 - 6,85). t=25°C.
19. Потенциал водородного электрода, опущенного в слюну, оказался равным - 0,3835 В. Рассчитайте рН слюны и определите, отвечает ли он норме (в норме рН слюны 6,35 - 6,85). t=25°C.
20. Потенциал водородного электрода, опущенного в сок поджелудочной железы, оказался равным – 0,472 В. Рассчитайте рН сока поджелудочной железы и определите, отвечает ли он норме (в норме рН этой биожидкости 7,5 - 8,0), t=25°C.
21. Потенциал водородного электрода, опущенного в раствор желчи (из пузыря) оказался равным - 0,354 В при 25°С. Рассчитайте рН желчи.
|
|
|
Задания в тестовой форме
«ЭЛЕКТРОХИМИЯ»
Задание: Укажите один или несколько вариантов правильных ответов
1. Какое свойство электролитов обеспечивает способность их растворов и расплавов проводить электрический ток?
A. низкая температура плавления
B. низкая температура кипения
C. способность диссоциировать на ионы
D. наличие свободных ионов
2. Что представляет собой носители зарядов в проводниках 2 рода?
A. свободные радикалы
B. свободные электроны
C. ионы
D. β-частицы
3. По какой из приведенных формул можно рассчитать удельную электрическую проводимость раствора, если известно сопротивление раствора?
A. 
B. 
C. 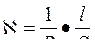
4. Что такое электропроводность растворов?
A. способность диссоциировать как ионы
B. способность проводить электрический ток
C. способность к электролизу
D. ни один из ответов не верен
5. Какую практическую задачу из указанных не возможно решать путем измерения электропроводности растворов?
A. идентификация веществ
B. титрование мутных растворов
C. определение степени диссоциации
D. определение константы диссоциации
6. Какие из перечисленных веществ при добавлении к воде будут значительно увеличивать электропроводность?
A. хлорид натрия
B. глюкоза
C. уксусная кислота
D. стеариновая кислота
7. Какие из перечисленных веществ при добавлении к воде будут увеличивать электропроводность?
A. нитрат калия
B. сахароза
C. мочевина
D. глюкоза
8. При добавлении каких перечисленных веществ к 0,1 н раствору CH3COOH электропроводность будет возрастать?
A. NaOH
B. HCN
C. CO2
D. BaSO4
9. Как изменится электропроводность 20 мл 0,1 н раствора соляной кислоты при добавлении 20 мл 0,1 н раствора гидроксида натрия?
A. сильно увеличится
B. сильно уменьшится
C. немного увеличится
D. немного уменьшится
10. Как изменится электропроводность 0,1 н раствора уксусной кислоты при добавлении к нему 0,2 моль/л CH3COONa?
A. не изменится
B. уменьшится
C. увеличится
D. в начале увеличится, а затем уменьшится
11. Как изменится электропроводность 20 мл 0,1 н раствора соляной кислоты при добавлении 20 мл 0,1 н раствора NaOH
|
|
|
A. увеличится
B. уменьшится
C. не изменится
D. в начале увеличится, а затем уменьшится
12. Что характеризует величина электропроводности растворов
A. силу взаимодействия ионов в растворе
B. способность проводить электрический ток
C. число Фарадея
D. число ионов в растворе
13. Какой из перечисленных факторов влияет на электропроводность растворов?
A. давление
B. концентрация ионов
C. скорость движения электронов
D. температура
14. Какие из перечисленных величин нужно знать для определения удельной электрической проводимости растворов?
A. удельное сопротивление
B. осмотическое давление
C. температура
D. подвижность ионов
15. По какой из написанных формул определяют разбавление раствора?
A. 
B. 
C. 
D. 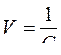
16. В каких единицах выражена СЭ в уравнении 
A. %
B. моль/экв.л
C. г/мл
D. моль/кг
17. По каким из приведенных формул можно рассчитать молярную электрическую проводимость раствора, если известна удельная электрическая проводимость?
A. 
B. 
C. 
D. 
18. Какие из перечисленных величин нужно знать для определения предельной молярной электрической проводимости?
A. температура
B. давление
C. молярная концентрация
D. молярная подвижность ионов
19. Каково соотношение между величинами молярной электрической проводимости растворов: 0,1 н р-р NH4OH и 0,1 н р-р NH4Cl
A. 
B. 
C. 
D. 
20. Как графически изображается зависимость молярной электрической проводимости от разбавления для сильных электролитов?


A. λ B. λ
V V

 C. λ D. λ
C. λ D. λ
V V
|
|
|
21. Какая из приведенных формул выражает математический закон Кольрауша?
A. 
B. 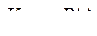
C. 
D. 
22. Какие из ионов H+ или NH4+ имеют большую молярную подвижность в водных растворах и почему?
A. ионы H+ как самые маленькие по размерам
B. ионы NH4+ за счет наличия донорно-акцепторной связи
C. ионы NH4+ за счет большой полярности
D. ионы H+ за счет “эстафетной” передачи протона между молекулами воды
23. Какие ионы обладают наибольшей подвижностью в водных растворах и почему?
A. многозарядные ионы, способные переносить большое количество электричества
B. ионы H+ и OH- как самые маленькие по размерам
C. ионы H+ и OH- за счет “эстафетной” передачи протона между молекулами воды
D. ионы H+ и OH- вследствие малой сольватации
24. Какой из ионов OH- или Cl- будет обладать большой подвижностью в водных растворах и почему?
A. ионы Cl-, из-за высокой электроотрицательности хлора
B. ионы OH- за счет эстафетной передачи протонов между молекулами воды
C. ионы OH- за счет малой сольватации
D. ионы хлора за счет большей поляризуемости
25. Какая из написанных формул формула Аррениуса?
A. 
B. 
C. 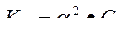
D. 
26. Какая из приведенных формул выражает математически закон разведения Оствальда?
A. 
B. 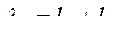
C. 
D. 
27. Какая из перечисленных величин не нужна для определения степени диссоциации слабого электролита?
A. температура
B. сопротивление раствора
C. молярные подвижности анионов
D. молярные подвижности катионов
28. Какая из формул выражает константу диссоциации угольной кислоты H2CO3 через степень диссоциации α и молярную концентрацию С?
A. 
B. 
C. 
D. 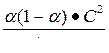
29. Какие из перечисленных величин нужно знать для определения константы диссоциации слабого электролита?
A. сопротивление раствора
B. вещество, из которого изготовлены электроды
C. молярные подвижности ионов
D. объем сосуда, в котором производят измерения
30. Цинковая пластинка, погруженная в раствор собственной соли, заряжается…
A. отрицательно, т.к. энергия гидратации больше, чем энергия кристаллической решетки
B. отрицательно, т.к. энергия гидратации меньше, чем энергия кристаллической решетки
C. положительно, т.к. энергия гидратации больше, чем энергия кристаллической решетки
D. положительно, т.к энергия гидратации меньше, чем энергия кристаллической решетки
31. Медная пластинка, погруженная в раствор собственной соли, заряжается…
A. отрицательно, т.к. энергия гидратации больше, чем энергия кристаллической решетки
B. отрицательно, т.к. энергия гидратации меньше, чем энергия кристаллической решетки
C. положительно, т.к. энергия гидратации больше, чем энергия кристаллической решетки
|
|
|
D. положительно, т.к энергия гидратации меньше, чем энергия кристаллической решетки
32. Электродный потенциал возникает на границе раздела металл – раствор его соли и обозначается…
A. Me | Men+
B. EMe|Men+
C. EMen+|Me
D. Men+ | Me
33. Условное обозначение водородного электрода…
A. Pt(H2) | 2H+
B. Cu(CuSO4) | 2H+
C. Zn(ZnSO4) | 2H+
D. Zn(ZnSO4) | HCl
34. У металлов, стоящих до водорода, стандартный электродные потенциалы…
A. положительные
B. отрицательные
C. равные нулю
35. Электродный потенциал при 298 К (25ºС) рассчитывается по уравнению Нернста:
A. 
B. 
C. 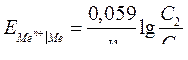
D. 
36. Уравнение Нернста для водородного электрода, находящегося в нестандартных условиях СН+ ≠ 1 моль/л при 298 К…
A. 
B. 
C. 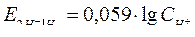
D. 
37. В гальваническом элементе анод…
A. заряжен положительно, на нем идет процесс окисления, т.е. отдачи электронов
B. заряжен отрицательно, на нем идет процесс окисления, т.е. отдачи электронов
C. заряжен положительно, на нем идет процесс восстановления, т.е. присоединения электронов
D. заряжен отрицательно, на нем идет процесс восстановления, т.е. присоединения электронов
38. При условном обозначении гальванических цепей записывают…
A. анод слева, катод справа
B. катод слева, анод справа
С. электрод, заряженный отрицательно, слева
D. электрод, заряженный положительно, слева
39. Электродвижущая сила гальванического элемента рассчитывается по формуле…
A. 
B. 
С. 
D. 
40. Уравнение Нернста для электрода I рода при 25ºС…
A. 
B. 
C. 
D. 
41. Уравнение Нернста для электрода II рода при 25ºС…
A. 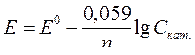
B. 
C. 
D. 
42. Потенциал окислительно-восстановительного электрода при 298 К рассчитывают по уравнению Петерса…
A. 
B. 
C. 
D. 
43. В элементе Якоби-Даниэля…
A. на цинковом электроде ионы цинка переходят в раствор
B. на цинковом электроде протекает реакция восстановления
C. на медном электроде осаждаются ионы меди из раствора
D. на медном электроде идет реакция окисления
44. Элемент Якоби-Даниэля схематично можно представить так:
A. (+) Cu | CuSO4 || ZnSO4 | Zn (-)
B. (+) Cu | Cu2+ || Zn2+ | Zn (-)
C. (-) Zn | ZnSO4 || CuSO4 | Cu (+)
D. (-) Zn | Zn2+ || Cu2+ | Cu (+)
45. Величина электродного потенциала металла зависит от…
A. удельной электропроводности
B. природы металла
C. активности ионов металла
D. температуры
46. ЭДС концентрационного гальванического элемента зависит от…
A. природы металла
B. заряда ионов металла
C. удельной электропроводности
D. соотношения концентраций растворов, в которые погружены электроды
47. Потенциал окислительно-восстановительного электрода зависит от ….
A. давления
B. природы окислительно-восстановительной пары
C. соотношения концентраций окисленной и восстановленной форм в растворе
D. заряд электрода
48. Электродвижущая сила со знаком “+” или “-“ гальванического элемента, составленного из стандартного водородного и стандартного данного электрода – это…
A. стандартный электродный потенциал металла
B. стандартный окислительно-восстановительный потенциал
C. стандартный концентрационный потенциал
D. стандартный диффузионный потенциал
49. Формула  выражает величину…
выражает величину…
A. диффузионного потенциала
B. мембранного потенциала
C. потенциала покоя
D. потенциала действия
50. Потенциометрия – это физико-химический метод анализа, позволяющий определить концентрации ионов на основании…
A. электрической проводимости растворов
B. данных фотоэлектроколориметрии
C. титрования растворов
D. измерения ЭДС гальванической цепи
51. При потенциометрических измерениях гальваническая цепь состоит из…
A. электрода сравнения
B. окислительно-восстановительного электрода
С. исследуемого раствора
D. электрода определения
52. Электрод II рода схематично изображаются так…
A. Me | Men+
B. Me, MeA | An-
C. Pt(H2) | 2H+
D. Pt | 
53. Выберите выражения, правильно характеризующие хлорсеребряный электрод.
A. условная запись Ag, AgCl | KClнас.
B. электрод сравнения
C. электрод определения
D. электродный потенциал равен нулю
54. Выберите выражения, правильно характеризующие стеклянный электрод.
A. электрод сравнения
B. электрод определения
C. применяется для определения рН в любых средах и при любых условиях
D. применяется для определения рН растворов
ЗАНЯТИЕ № 14
|
|
|


