 |
Міністерство освіти і науки України
|
|
|
|
Міністерство освіти і науки України
Національний авіаційний університет
Аналітична хімія
Кількісний аналіз
Лабораторний практикум
для студентів спеціальності
7. 091604 “Хімічна технологія палива
і вуглецевих матеріалів”
КИІВ 2002
ВСТУП
Контроль якості паливно-мастильних та інших матеріалів, які використовуються в авіації і космонавтиці, а також управління їх виробництвом, здійснюється за допомогою хіміко-аналітичних методів. У цьому лабораторному практикумі наведені приклади кількісних визначень, які належать до найважливіших розділів класичного хімічного аналізу: гравіметрії та титрометрії. Остання група методів представлена методами кислотно-основного титрування, перманганатометрії, йодометрії, об¢ ємного методу осадження та комплексонометрії. З метою наближення підготовки студентів до обраної ними спеціальності у практикумі подані методики хіміко-аналітичного визначення деяких компонентів вуглеводневих матеріалів.
Структура та зміст лабораторного практикуму передбачає збільшення за обсягом самостійної роботи студентів над конспектом лекцій та літературою з метою покращення якості їх знань. . У практикумі відсутні теоретичні відомості, проте список рекомендованої літератури приведено в кінці брошури. Значну допомогу в засвоєнні матеріалу дають і хімічні лабораторні досліди, тому й наводимо обсяг вимог (програм) і методик до виконання лабораторних робіт. Рівень самопідготовки студентів передбачено визначати шляхом виконання домашнього завдання, усного та письмового опитування в лабораторії.
|
|
|
Даний практикум укладено відповідно до навчальної програми з хімії для студентів вищих навчальних закладів спеціальності 7. 091604 “Хімічна технологія палива і вуглецевих матеріалів”.
ГРАВІМЕТРІЯ
Лабораторна робота 1
визначення заліза (ІІІ)
Завдання для домашньої підготовки
Завдання та методи кількісного хімічного аналізу. Класифікація методів кількісного хімічного аналізу. Сутність гравіметричного (вагового) методу аналізу.
Вимоги до осадів у ваговому аналізі. Добуток розчинності і його застосування у гравіметрії. Кристалічні та аморфні осади. Перенасичені розчини. Умови одержання осадів і їх вагової форми.
Прилади, посуд і реактиви. Конструкція аналітичних терезів і правила зважування на них. Основні операції гравіметрії. Методика гравіметричного визначення заліза (ІІІ).
Теоретичні запитання і задачі
1. Сформулюйте найважливіші вимоги до осадів, які застосовуються у гравіметрії.
2. Наведіть декілька прикладів кристалічних та аморфних осадів. Чим вони відрізняються?
3. Чи утвориться осад, якщо до 0, 02 моль/л розчину AgNO3 додати такий самий об¢ єм 0, 05 моль/л розчину Н2SO4 (ДР 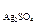 = =2, 10-5)?
= =2, 10-5)?
3. До насиченого розчину оксалату кальцію (ДP = 1, 6× 10-9) додали стільки оксалату амонію, що його концентрація досягала 0, 01 моль/л. У скільки разів змінилась концентрація іонів Са2+ у розчині?
5. Чому дорівнює необхідна та достатня межа розчинності осадів у ваговому аналізі? Відповідь обґрунтуйте розрахунком.
6. Обчисліть розчинність гідроксиду заліза (ІІІ) при рН = 7.
7. Для промивки осаду гідроксиду заліза (ІІІ) надані такі розчини: а) суміш нітрату і гідроксиду амонію; б) нітрату заліза; в) дистильована вода; г) їдкого лугу; д) нітрату амонію; є) гідроксиду амонію. Який з них слід вибрати? Відповідь мотивуйте.
|
|
|
Експериментальна частина
1. Одержання осаду
Розчин хлориду заліза (ІІІ) перенесіть у хімічну склянку, додайте 3–5 мм 2 н. розчину азотної кислоти і обережно нагрійте його на електричній плиті до 70–90 °С. До гарячого розчину повільно, краплями, при постійному помішуванні додайте 10%-вий розчин аміаку до відчутного його запаху. Потім суміш розведіть гарячою дистильованою водою до об¢ єму 100–150 мл і перемішайте. Дайте осаду відстоятись протягом декількох хвилин і проведіть перевірку на повноту осадження.
2. Фільтрування і промивка осаду
Осад відфільтруйте через беззольний фільтр “червона стрічка”. Для цього більшу частину освітленого розчину злийте (декантуйте) на фільтр, потім осад промийте 2–3 рази гарячим 2%-вим розчином нітрату амонію з добавкою невеликої кількості концентрованого розчину гідроксиду амонію. Кількісно, за допомогою шматочка фільтрувального паперу і невеликих об¢ ємів промивного розчину перенесіть осад на фільтр. Промивайте осад на фільтрі до повного видалення хлорід-іонів, що визначається якісною реакцією на іони Cl- у промивних водах за допомогою розчину нітрату срібла.
|
|
|


