 |
об’ємний метод осадження. Лабораторна робота 9. Аргентометричне визначення хлоридів. Завдання для домашньої підготовки
|
|
|
|
ОБ’ЄМНИЙ МЕТОД ОСАДЖЕННЯ
Лабораторна робота 9
Аргентометричне визначення хлоридів
Завдання для домашньої підготовки
Сутність методів осадження. Меркурометрія та аргентометрія, сфери їх застосування. Метод Мора (прямого титрування) і метод Фольгарда (зворотного титрування). Вихідні речовини, робочі розчини і індикатори аргентометрії.
Методика визначення хлорид-іонів у розчині.
Теоретичні запитання і задачі
1. поясніть на прикладі аргентометрії різницю між прямим і зворотним титруванням.
2. поясніть, чому осад хромату срібла утворюється тільки після зв’язування хлорид-іонів у AgCl при титруванні хлоридів нітратом срібла? Чи можна замінити у методі Мора хромат калію йодидом калію або сульфідом натрію, які теж утворюють з іонами срібла осад?
3. Які хімічні реакції перебігають при визначенні хлорид-іонів за методом Фольгарда? У чому переваги цього методу перед методом Мора?
4. Наважку 1, 5675 г технічного хлориду натрію розчинили у мірній колбі на 250 мл. На титрування 25, 0 мл цього розчину пішло 27, 1 мл 0, 0980 н. розчину нітрату срібла. Визначте масову частку NaCl у взятій пробі.
5. 3, 3845г хлориду натрію розчинили у воді і довели об’єм розчину до 200 мл. до 25 мл одержаного розчину додали 25 мл 0, 1 н. розчину нітрату срібла. Визначте нормальність розчину роданіду амонію, якщо на титрування надлишку нітрату срібла пішло 25 мл його розчину.
Експериментальна частина
1. Встановлення нормальності розчину нітрату срібла
Хлорид натрію попередньо перекристалізуйте у присутності соляної кислоти. Одержаний хлорид натрію промийте, висушіть при температурі 500–600 оС. З цієї солі, шляхом взяття точної наважки, приготуйте 0, 05 н. розчин.
|
|
|
2. Приготування і встановлення нормальності розчину
роданіду амонію
Враховуючи, що молярна маса еквівалента роданіду амонію дорівнює його молярній масі, розрахуйте наважку, необхідну для приготування 250 мл 0, 05 н. розчину цієї солі, зважте її на хіміко-технічних терезах, розчиніть у невеликій кількості води і розчин перенесіть у колбу на 250 мл, довівши об’єм розчину до позначки, перемішайте.
У конічну колбу відберіть 10 мл 0, 05 н. розчину нітрату срібла, долийте 1 мл розчину залізо-амонійного галуна, а також 2–3 мл 6 н. розчину азотної кислоти. Розчин титруйте розчином роданіду амонію при постійному перемішуванні. Титрування припиніть з появою коричнево-рожевого забарвлення, що не зникає при збовтуванні. Це забарвлення свідчить про досягнення у процесі титрування точки еквівалентності, оскільки надлишкова крапля роданіду викликає утворення комплексу його із залізом (ІІІ):
Fe3+ + SCN- = [FeSCN]2+.
За результатами двох титрувань, відомим об’ємом і нормальністю розчину нітрату срібла визначте нормальність розчину роданіду амонію.
3. Визначення хлоридів
Одержаний розчин хлориду перенесіть у мірну колбу місткістю на 100 мл, додайте дистильовану воду до позначки і відберіть 20 мл у колбу для титрування. Долийте 2–3 краплини розчину галуна і перенесіть у колбу. За допомогою піпетки 10 мл 0, 05 н. розчину нітрату срібла. Над- лишок срібла титруйте розчином роданіду амонію до появи коричнево-рожевого забарвлення, яке не зникає при інтенсивному збовтуванні.
Обчислення маси хлориду у пробі проведіть за формулою:
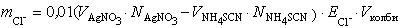 .
.
КОМПЛЕКСОНОМЕТРІЯ
Лабораторна робота 10
визначення магнію,
загальної твердості води
ТА СВИНЦЮ У БЕНЗИНАХ
Завдання для домашньої підготовки
|
|
|
Загальні уявлення про комплексні сполуки. Реакції комплексо- утворення в кількісному аналізі. Комплексони. Можливості комп- лексонометрії (трилонометрії) у визначенні металів. Індикатори комплексонометрії.
Загальна твердість води та методика її трилонометричного визначення.
Комплексонометричне визначення металів у вуглеводневих рідинах.
Теоретичні запитання і задачі
1. Наведіть графічне зображення формули комплексона ІІІ. Поясніть, чому ЕДТА та її солі утворюють комплекси практично з усіма металами зі співвідношенням метал: ліганд = 1: 1.
2. У чому полягає механізм дії індикатора еріохром-чорного Т?
3. Чим викликана необхідність додавання аміачного буферного розчину до розчину, який титрують трилоном Б при визначенні іонів магнію та загальної твердості води? Який склад буферної суміші?
4. Приведіть розрахунок наважки трилону Б, необхідної для приготування 0, 5 л 0, 1н його розчину.
5. Присутністю яких солей у природній воді зумовлена тимчасова, постійна та загальна її твердість? Які методи хімічного аналізу слід застосовувати для визначення усіх цих видів твердості води?
6. При визначенні нормальності розчину трилону Б на титрування 25, 0 мл пішло 22, 5 мл 0, 1н розчину сульфату магнію. Розрахуйте загальну твердість води, на титрування 100 мл якої пішло 17, 3 вказаного робочого розчину.
Експериментальна частина
|
|
|


