 |
3. Встановлення нормальності перманганату калію
|
|
|
|
3. Встановлення нормальності перманганату калію
Відберіть піпеткою 10 мл розчину щавлевої кислоти, перенесіть у колбу для титрування, додайте 8 мл 2 н. розчину сірчаної кислоти, розчин нагрійте до 70–80оС (але не вище! ). Гарячий розчин титруйте розчином перманганату калію до появи блідо-рожевого забарвлення, стійкого протягом 1–2 хв. З трьох паралельних титрувань визначіть середнє значення об’єму розчину перманганату калію і розрахуйте точну його нормальність.
Лабораторна робота 7
визначення заліза(ІІ)
і пероксиду водню
Завдання для домашньої підготовки
Теоретичні основи перманганатометричного визначення відновників. Методика визначення вмісту заліза (ІІ) у солі Мора і залізному купоросі.
Методика визначення пероксиду водню у водному розчині.
Теоретичні запитання і задачі
1. Обчисліть молярні маси еквівалентів солі Мора (NH)2Fe(SO4)2 . 6H2O і залізного купоросу FeSO4 . 7H2O.
2. Чому титрування щавлевої кислоти проводять при температурі розчину не вищої за 70–80 0С? Обґрунтуйте рівнянням реакції.
3. Чому титрування солей заліза (ІІ) і пероксиду водню необхідно виконувати на холоді? Напишіть рівняння реакцій, які можуть відбуватися з цими речовинами при нагріванні.
4. Яку помилку допущено в ході аналізу, якщо під час титрування перманганатом калію розчин помутнів?
5. Чим пояснюється затримка знебарвлення перманганату калію на початку титрування?
6. У 200 мл розчину знаходиться 0, 25г пероксиду водню. Яка нормальність розчину перманганату калію, якщо на титрування 20 мл розчину пероксиду водню витрачено 24, 6 мл розчину перманганату калію?
|
|
|
Експериментальна частина
1. Визначення вмісту заліза (ІІ) у солі Мора або у залізному купоросі
Визначення заліза (ІІ) проводять прямим титруванням його перманганатом калію у середовищі сірчаної кислоти:
5Fe 2+ +  + 8H + = 5Fe3++ Mn2+ + 4H2O.
+ 8H + = 5Fe3++ Mn2+ + 4H2O.
До розчину солі заліза (ІІ), що аналізується у мірній колбі, додайте дистильовану воду до позначки і ретельно перемішайте. Піпеткою відберіть аліквотнучастину цього розчину і перенесіть у конічну колбу для титрування. Розчин підкисліть 2 н. розчином сірчаної кислоти (8 мл H2SO4 на 10 мл розчину ) і титруйте на холоді розчином перманганату калію до появи стійкого рожевого забарвлення. Щоб іони заліза (ІІ) не окиснювались киснем, треба уникати тривалого контакту розчину з повітрям. Проведіть розрахунок нормальності Fe2+ у розчині, що аналізується, маси заліза (ІІ) у пробі і маси солі Мора або залізного купоросу.
2. Визначення пероксиду водню
Перманганатометричний метод визначення пероксиду водню базується на окисленні його до вільного кисню згідно з рівнянням реакції:
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 +8 H2O.
З якого видно, що
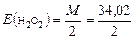 = 17, 01 г/моль.
= 17, 01 г/моль.
Одержаний для аналізу розчин пероксиду в мірній колбі розведіть водою до позначки і перемішайте. Відберіть для титрування аліквотну частину, додайте розчин сірчаної кислоти (див. лабораторну роботу 6) і повільно титруйте робочим розчином перманганату калію до появи стійкого блідо-рожевого забарвлення. Знайшовши за результатами трьох титрувань об’єм перманганату калію, розрахуйте нормальність і масу пероксиду водню у виданому розчині.
Йодометрія
Лабораторна робота 8
ВИЗНАЧЕННЯ МІДІ ТА АРСЕНУ
Завдання для домашньої підготовки
Сутність йодометрії. Йодометричне визначення окисників, відновників і кислот. Переваги та недоліки йодометричного методу. Джерела можливих похибок при виконанні аналізів та способи їх усунення. Умови проведення йодометричних визначень.
|
|
|
Інші методи оксидиметрії.
Приготування робочих розчинів тіосульфату натрію та йоду і умови їх зберігання. Приготування та використання крохмалю. Йодометричне визначення міді та арсену.
Теоретичні запитання і задачі
1. У чому полягає суттєва відмінність між методами перманганатометрії та йодометрії?
2. Назвіть дві основні причини, внаслідок яких не можна безпосередньо титрувати дихромат калію тіосульфатом.
3. Для йодометричного визначення міді наважкулатуні розчинили в азотній кислоті, розвели водою, додали йодид калію і відтитрували тіосульфатом натрію.
результати аналізу виявилися неправильними. Яку операцію було пропущено?
4. Яку роль відіграє йодид калію в йодометрії?
5. У 200 мл розчину міститься 0, 98 г дихромату калію. Визначте титр розчину дихромату та його нормальну концентрацію.
6. Який об’єм 0, 5н. розчину тіосульфату натрію було витрачено на титрування йоду, що виділився при взаємодії 50 мл 0, 2 н. розчину перманганату калію з надлишком йодиду калію у кислому середовищі?
Експериментальна частина
|
|
|


