 |
Теоретичні запитання і задачі. 1. Визначення соди титруванням у присутності метилоранжу. 2. Визначення соди титруванням у присутності фенолфталеїну
|
|
|
|
Теоретичні запитання і задачі
1. Складіть таблицю, що відображатиме такі дані: забарвлення індикаторів лакмусу, метилоранжу, метилового червоного та фенолфталеїну у кислотному, нейтральному та лужному середовищах, їх інтервали переходу і показники титрування.
2. Обчисліть рН і рОН 0, 1 н. і 10 н. розчинів соляної кислоти і гідроксиду натрію.
3. Складіть рівняння гідролізу хлориду алюмінію і сульфіду калію та запропонуйте спосіб їх визначення методом нейтралізації.
4. Чому дорівнює рН розчину, що містить 0, 1 г оцтової кислоти у 500 мл розчину (  )
)
5. Яку нормальність повинен мати розчин соляної кислоти, щоб 1 мл його міг нейтралізувати 0, 0625 г гідрокарбонату натрію?
6. Чому дорівнює рН 0, 15%-вого розчину їдкого калі? Густину розчину прийміть рівною 1 г/см3.
Експериментальна частина
Визначення вмісту соди можна здійснити, використовуючи як індикатор метилоранж або фенолфталеїн. При титруванні з метилоранжем сода нейтралізується за реакцією:
Na2CO3 + 2HCl = H2CO3 + 2NaCl.
При цьому молярна маса еквівалента соди дорівнює:
 = 53 г/моль.
= 53 г/моль.
При титруванні з фенолфталеїном реакція перебігає за рівнянням:
Na2CO3 + HCl = NaHCO3 + NaCl.
еквівалентна маса соди дорівнює:
 = 106 г/моль.
= 106 г/моль.
Виконайте титрування з обома індикаторами, використовуючи робочий розчин соляної кислоти, приготовлений під час попередньої лабораторної роботи.
1. Визначення соди титруванням у присутності метилоранжу
Аліквотну частину розчину перенесіть у конічну колбу і додайте одну-дві каплі метилоранжу. Титруйте робочим розчином соляної кислоти до переходу жовтого кольору розчину у блідо-рожевий. За результатами трьох титрувань обрахуйте середнє значення VHCl.
|
|
|
Розрахунки маси соди здійсніть за формулою:
 .
.
2. Визначення соди титруванням у присутності фенолфталеїну
Виконання роботи подібне до попереднього. Введення 4–5 краплин фенолфталеїну в розчин забарвлює його в малиновий колір. Титрування соляною кислотою призводить до знебарвлення розчину, яке остаточно відбувається при додаванні однієї надлишкової краплини кислоти.
Розрахунок вмісту (маси) соди здійснюється аналогічно попередньому, при цьому відрізняються лише величини об¢ єму кислоти і молярної маси еквіваленту соди. Порівняйте результати обох визначень.
3. Визначення карбонатної твердості води
Карбонатна або тимчасова твердість води зумовлена наявністю у ній такої кількості іонів Са2+ і Mg2+, яка еквімолярна кількості іона  . Тому для її визначення гідрокарбонат-іони титрують соляною кислотою відповідно до реакції
. Тому для її визначення гідрокарбонат-іони титрують соляною кислотою відповідно до реакції
 + H+ = H2CO3.
+ H+ = H2CO3.
Згідно із сучасними стандартами, твердість води виражають у міліграм-еквівалентах розчинених солей кальцію і магнію, тобто фактично обчислюють нормальність за цими іонами і збільшують її у 1000 разів.
Для аналізу відберіть мірним циліндром 100 мл води, прилийте до неї 2–3 краплини метилоранжу і титруйте воду робочим розчином соляної кислоти до переходу забарвлення розчину з жовтого у рожевий.
Розрахунок проведіть за формулою:
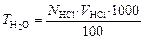 .
.
4. Титрометричне визначення кислотності рідких палив
4. 1. Встановлення титру спиртового розчину гідроксидукалію
У конічну колбу місткістю 100–150 мл внесіть 0, 05–0, 07 г янтарної кислоти або дифталату калію і розчиніть наважку в 50 мл дистильованої води. До розчину додайте 3–4 краплини фенолфталеїну і титруйте його 0, 05 н. розчином гідроксиду калію до появи стійкого рожевого забарвлення.
Титр розчину гідроксиду калію (мг КОН/мл) обчисліть за формулою:
|
|
|
 ,
,
де m — маса янтарної кислоти, або дифталату калію, г; Е — молярна маса еквівалента янтарної кислоти або дифталату калію, г/моль; V — об¢ єм 0, 05 н. розчину гідроксиду калію, мл.
Остаточним результатом визначення титру робочого розчину є середнє арифметичне значення за даними трьох титрувань.
4. 2. Методика аналізу
Перед проведенням титрування пробу палива перемішуйте протягом 5 хв. У конічну колбу налийте 50 мл 85%-вого етанолу та прокип¢ ятіть його зі зворотним холодильником протягом 5 хв. У гарячий етанол додайте 8–10 краплин індикатора нітрозинового жовтого і титруйте робочим розчином гідроксиду калію до переходу забарвлення розчину з жовтого у зелений.
У колбу з нейтралізованим етанолом долийте 50 мл палива, що аналізується. Суміш знову прокип¢ ятіть 5 хв., використовуючи зворотний холодильник. Далі титруйте гарячий розчин робочим розчином гідроксиду калію до переходу жовтого кольору у зелений.
Кислотність проби палива (К) і кількість витраченого гідроксиду калію (мг КОН на 100 мл палива) обчисліть за формулою: 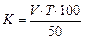 .
.
|
|
|


