 |
1. Приготування і встановлення нормальності розчину тіосульфату за дихроматом калію
|
|
|
|
1. Приготування і встановлення нормальності розчину тіосульфату за дихроматом калію
З рівняння реакції взаємодії йоду і тіосульфату натрію випливає, що:
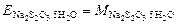 = 248, 2 г/моль.
= 248, 2 г/моль.
Розрахуйте наважку тіосульфату натрію, необхідну для приготування 0, 5 л 0, 05 н. його розчину. Наважку візьміть на технічних терезах, розчиніть її у 500 мл дистильованої води і ретельно перемішайте розчин.
Приготуйте 250 мл 0, 05 н. стандартного розчину дихромату калію. Для цього розраховану його наважку зважте на аналітичних терезах, розчиніть і кількісно перенесіть у мірну колбу, доведіть об’єм розчину до риски і ретельно перемішайте.
Для встановлення нормальності тіосульфату натрію в колбу для титрування внесіть 15 мл відміряного циліндром 10%-вого розчину йодиду калію і 20–25 мл 2 н. розчину сірчаної кислоти. Туди ж піпеткою додайте 10 мл приготовленого перед цим 0, 05 н. розчину дихромату калію. Залиште суміш у темряві на 5 хв. Далі титруйте розчин тіосульфатом натрію до тих пір, поки забарвлення з темно-бурого не стане світло-жовтим, а потім додайте 2–3 мл крохмалю. Дотитруйте розчин до переходу темно-синього забарвлення у світло-зелений, зумовлений присутністю іонів хрому (ІІІ). Розрахуйте нормальність тіосульфату за відомою формулою.
2. Визначення міді
Визначення міді (ІІ) базується на її відновленні до міді (І) йодид-іонами, що супроводжується виділенням еквівалентної кількості вільного йоду згідно з рівнянням реакції:
2CuSO4 + 4KI = 2CuI ¯ + 2K2 SO4 + I2 .
Йод, що виділився, титрують розчином тіосульфату натрію.
Розчин міді, що аналізується, у мірній колбі доведіть до позначки і перемішайте. За допомогою піпетки перенесіть 10 мл розчину в колбу для титрування, додайте 5 мл 2 н. розчину сірчаної кислоти і 10–15 мл 10%-вого розчину йодиду калію. Залиште це у темряві на 5 хв., а далі титруйте розчином тіосульфату натрію. В кінці титрування, при “солом’яно-жовтому” забарвленні розчину, додайте крохмаль. Титрування припиніть, коли зникне синє забарвлення розчину і залишиться білий осад.
|
|
|
Обчисліть за стандартними формулами нормальність розчину міді у мірній колбі та її загальну масу в пробі. Еквівалент міді, як видно з рівнянням реакції, дорівнює його атомній масі.
3. приготування і визначення нормальності робочого розчину йоду
Приготування робочого розчину йоду, що застосовується для визначення відновників, можна здійснити шляхом взяття точної його наважки. Проте цей спосіб пов’язаний зі значними труднощами, які зумовлені, у першу чергу, леткістю йоду.
Тому визначте масу наважки, необхідну для приготування 250 мл 0, 05 н. розчину йоду, зважте її на технічних терезах і розчиніть у воді, додавши попередньо трикратну кількість йодиду калію. Розчин перенесіть у мірну колбу, доведіть його об’єм до позначки і перемішайте.
Заповніть розчином йоду бюретку. У конічну колбу для титрування відберіть 10 мл тіосульфату натрію, додайте 2–3 краплини крохмалю і титруйте розчином йоду до появи синього забарвлення. Титрування проведіть три рази. Скориставшись середнім значенням об’єму йоду і відомою концентрацією тіосульфату, обчисліть точну нормальність розчину йоду.
4. йодометричне визначення арсену
Йодометричний метод застосовується для визначення як тривалентного, так і п’ятивалентного арсену. Визначення п’ятивалентного арсену базується на тому, що у сильнокислому розчині арсенати відновлюються йодидом калію з виділенням еквівалентної кількості вільного йоду, який потім титрують розчином тіосульфату натрію. Навпаки, у слабколужному середовищі арсеніти легко окиснюються вільним йодом до арсенатів.
|
|
|
В основі визначення арсенітів лежить реакція:
 + I2 +H2O =
+ I2 +H2O =  + 2H+ + 2I –.
+ 2H+ + 2I –.
Для нейтралізації кислоти зручніше за все застосовувати гідрокарбонат натрію:
NaHCO3 + HI = NaI + H2CO3.
При цьому утворюється буферна суміш (H2CO3 + NaHCO3), pH якої змінюється у межах 6–7.
До розчину арсеніту натрію прилийте кислоту або луг до слабкокислої реакції за фенолфталеїном, потім додайте 1 г гідрокарбонату натрію і, після його розчинення, 2–3 мл крохмалю. Одержаний розчин титруйте робочим розчином йоду до появи незникаючого синього забарвлення. У кінці титрування реакція уповільнюється, внаслідок чого синє забарвлення з’являється ще до появи точки еквівалентності. Проте забарвлення швидко зникає, тому титрування треба проводити до виникнення стійкого забарвлення, яке не зникає при перемішуванні розчину. Зробіть необхідні обчислення.
|
|
|


