 |
ДОДАТОК. Таблиця 1. Константи нестійкості деяких комплексних іонів. Стандартні електродні потенціали деяких окисно-відновних систем
|
|
|
|
ДОДАТОК
Таблиця 1
Густина розчинів деяких кислот, лугів і аміаку при 15 оС, г/см3
| Масова частка | H2SO4 | HNO3 | HCl | KOH | NaOH | NH3 |
| 1, 013 1, 027 1, 040 1, 055 1, 069 1, 083 1, 098 1, 112 1, 127, 1, 143 1, 158 1, 74 1, 190 1, 205 1, 224 1, 238 1, 255 1, 273 1, 290 1, 307 1, 324 1, 342 1, 261 1, 380 1, 399 | 1, 011 1, 022 1, 033 1, 044 1, 056 1, 068 1, 080 1, 093 1, 106 1, 119 1, 132 1, 145 1, 158 1, 171 1, 184 1, 198 1, 211 1, 225 1, 238 1, 251 1, 264 1, 277 1, 290 1, 303 1, 31 | 1, 009 1, 019 1, 029 1, 039 1, 049 1, 059 1, 069 1, 079 1, 083 1, 100 1, 10 1, 121 1, 132 1, 142 1, 152 1, 163 1, 173 1, 183 1, 194 | 1, 016 1, 033 1, 048 1, 065 1, 082 1, 100 1, 118 1, 137 1, 156 1, 176 1, 196 1, 217 1, 240 1, 263 1, 286 1, 310 1, 334 1, 358 1, 384 1, 411 1, 437 1, 460 1, 485 1, 511 1, 538 | 1, 023 1, 046 1, 069 1, 092 1, 115 1, 137 1, 159 1, 181 1, 213 1, 225 1, 247 1, 268 1, 289 1, 310 1, 332 1, 352 1, 374 1, 395 1, 416 1, 437 1, 458 1, 478 1, 499 1, 519 1, 540 | 0, 992 0, 983 0, 973 0, 967 0, 980 0, 953 0, 946 0. 939 0, 932 0, 926 0, 919 0, 913 0, 906 0, 903 0, 898 0. 893 0, 889 0, 884 |
Закінчення табл.. 1
| Масова частка | H2SO4 | HNO3 | HCl | KOH | NaOH | NH3 |
| 1, 419 1, 439 1, 460 1, 482 1, 503 1, 52 1, 547 1, 571 1, 617 1, 664 1, 710 1, 755 1, 808 1, 830 1, 841 1, 838 | 1, 328 1, 340 1, 351 1, 362 1, 373 1, 384 1, 394 1, 401 1, 421 1, 437 1, 453 1, 467 1, 486 1, 296 1, 510 1, 522 | 1, 564 1, 590 1, 616 | 1, 560 1, 580 1, 601 1. 622 1, 643 |
Таблиця 2
Константи нестійкості деяких комплексних іонів
| Комплексний іон | Кнест. | Комплексний іон | Кнест. |
| [Ag(CN)2] - [Ag(CH3)2]+ [Ag(S2O3)2]3- [CdCl4]2- [Cd I4]2- [Cd(CN)4]2 - [Cd(NH3)6]2+ [Cd(NH3)4]2+ [Co(NH3)6]3+ [Cu(NH3)4]2+ [Cu(CN)4]3+ | 1 . 10-21 9 . 10-8 1 . 10-13 9 . 10-3 8 . 10-7 1 . 10-17 8 . 10-8 8 . 10-6 6 . 10-36 2 . 10-13 5 . 10-28 | [Fe(CN)6]4- [Fe(CN)6]3- [Fe(SCN)]2+ [HgBr]2- [Hg Cl4]2- [Hg I4]2- [Hg (SCN)4]2- [Ni(SCN)4]2+ [Ni(NH3)6]2+ [Zn(CN)4]2- [Zn(NH)3]2+ | 1 . 10-24 1 . 10-31 1 . 10-3 1 . 10-21 8 . 10-16 1 . 10-30 1 . 10-22 3 . 10-16 2 . 10-9 2 . 10-17 4 . 10-10 |
Таблиця 3
|
|
|
Стандартні електродні потенціали деяких окисно-відновних систем
| Окиснена форма | Відновна форма | Рівняння реакції | Ео, В |
| Li+ | Li(кр) | Li+ + е– = Li | –3, 04 |
| Ca2+ | Ca(кр) | Ca2+ + 2e– = Ca | –2, 87 |
| SO32- | S(кр) |  + 4e– + 3H2O = S + 6OH– + 4e– + 3H2O = S + 6OH–
| –0, 90 |
| AsO43- | AsO2 |  + 2e– + 2H2O = + 2e– + 2H2O = 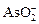 + 4OH– + 4OH–
| –0, 67 |
| H3PO4 | P(кр) | Н3РО4 + 5e– + 5Н+ = Р + 4Н2О | –0, 41 |
| 2H+ | H2(г) | 2H+ + 2e– = H2 | 0, 00 |
| Sn4+ | Sn | Sn4+ + 2e– = Sn2+ | +0, 15 |
| S(кр) | H2S(г) | S + 2e– + 2H+ = H2S | +0, 17 |
| IO3- | I– |  + 6e– + 3H2O = I– + 6OH– + 6e– + 3H2O = I– + 6OH–
| +0, 25 |
| SO42 | H2S(г) | 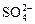 + 8e– + 10H2O = H2S + 4H2O + 8e– + 10H2O = H2S + 4H2O
| +0, 31 |
| SO42- | S(кр) | SO42-+ 6e– + 8H2O = S + 4H2O | +0, 31 |
| I2 | 2I– | I2 + 2e– = 2I– | +0, 54 |
| MnO4- | MnO42- | MnO4- + e– = MnO42- | +0, 56 |
| MnO4- | MnO2(кр) | MnO4- + 3e– + 2H2O = MnO2 + 4OН– | +0, 56 |
| O2(г) | H2O2 | O2 + 2e– + 2H+ = H2O2 | +0, 68 |
| Fe3+ | Fe2+ | Fe3++ e– = Fe2+ | +0, 77 |
| NO3- | NO(г) | NO3- + 3e– + 4H+ = NO(г) + 4H2O | +0, 78 |
| NO3- | NH4+ | NO3- + 8e– + 10H+ = NH4+ + 3H2O | +0, 87 |
| NO3- | NO2(г) | NO3- + 4e– + 2H+ = NO2(г) + H2O | +0, 96 |
| Br2(р) | 2Br2+ | Br2 + 2e– = 2Br– | +1, 07 |
| MnO2(кр) | Mn2+ | MnO2 + 2e– + 4H+ = Mn2+ + 2H2O | +1, 23 |
| СrO72- | 2Cr3+ | СrO72- + 6e– + 14H+ = 2Cr3+ + 7H2O | +1, 33 |
| HBrO | Br– | HBrO + 2e– + H+ = Br– + Н2O | +1, 34 |
| Cl2 | 2Cl– | Cl2 + 2e– = 2Cl– | +1, 38 |
| ClO4– | Cl– | ClO4– + 8e– + 8H+ = Cl– + 4H2O | +1, 44 |
| BrO3– | Br– | BrO3– + 6e– + 6H+ = Br– + 3H2O | +1, 45 |
| PbO2 | Pb2+ | PbO2 + 2e– + 4H+ = Pb2++ 2H2O | +1, 45 |
| H2O2 | H2O | H2O2 + 2e– + 2H+ = 2H2O | +1, 78 |
| BiO3- | Bi3+ | BiO3- + 2e– + 6H+ = Bi3+ + 3H2O | +1, 80 |
| Co3+ | Co2+ | Co3+ + e– = Co2+ | +1, 81 |
| S2O82- | 2SO42 | S2O82- + 2e– = 2SO42 | +2, 01 |
| F2 | 2F– | F2 + 2e– = 2F– | +2, 87 |
Таблиця 4
Добуток розчинності малорозчинних речовин при 25о С
| Речовина | ДР | Речовина | ДР |
| AgBr AgCN Ag2S AgSCN AgCl Ag2Co3 Ag2Cr2O4 AgI BaCO3 BaC2O4. 2H2O BaCrO4 BaSO4 CaCO3 CaC2O4. 2H2O CaSO4. 2H2O CdS Co(OH)2 CuC2O4 Cu2S CuS Fe CO3 Fe(OH)2 Fe(OH)3 | 6 . 10 –13 7 . 10 –15 6 . 10 –50 1, 1 . 10 –12 1, 8 . 10 –10 8, 3 . 10 –12 4 . 10 –12 1, 1 . 10 –16 5 . 10 –9 1, 1 . 10 –7 1, 6 . 10 –12 1, 1 . 10 –10 5 . 10 –9 2 . 10 –9 1 . 10 –5 1 . 10 –29 2 . 10 –16 2, 5 . 10 –22 1 . 10 –48 6 . 10 –36 2, 5 . 10 –11 1 . 10 – 15 3, 8 . 10 – 38 | FeS Hg2Cl2 Mg(OH)2 MgS Mn(OH)2 MnS NiCO3 Ni(OH)2 PbCO3 Pb2Cl2 PbCrO4 PbI2 Pb(OH)2 PbS PbSO4 Sb2S3 SnS SrCO3 SrC2O4. 2H2O SrSO4 Zn(OH)2 ZnS | + 5 . 10 –18 1, 3 . 10 –18 2 . 10 –11 2 . 10 –15 2 . 10 –13 2, 5 . 10 –10 1, 3 . 10 –7 10 – 15 - 10 –18 7, 5 . 10 –14 2 . 10 –6 1, 8 . 10 –14 8 . 10 –9 2 . 10 –16 1 . 10 – 27 1, 6 . 10 –8 1 . 10 –30 1 . 10 –26 1, 1 . 10 –10 5, 5 . 10 –8 3, 2 . 10 –7 1 . 10 –17 1, 6 . 10 –24 |
ЗМІСТ
|
|
|
Вступ 3
Гравіметрія
Лабораторна робота 1
Визначення заліза (III) 4
Лабораторна робота 2
Визначення барію 6
Лабораторна робота 3
Визначення механічних домішок у вуглеводневих
паливах 8
Метод кислотно-основного титрування
Лабораторна робота 4
Приготування робочого титрованого розчину соляної
кислоти 10
Лабораторна робота 5
Визначення вмісту соди, карбонатної твердості води
і кислотності рідких палив 13
Перманганатометрія
Лабораторна робота 6
Приготування робочого розчину перманганату калію
і визначення його нормальності 17
Лабораторна робота 7
Визначення заліза!! і пероксиду водню 19
Йодлметрія
Лабораторна робота 8
Визначення міді та арсену 21
Об`ємний метод осадження
Лабораторна робота 9
Аргенометричне визначення хлоридів 25
Комплексонометрія
Лабораторна робота 10
Визначення магнію, загальної твердості води та
свинцю у бензинах 27
|
|
|
Список літератури 31
Додаток 32
|
|
|


