 |
Системы с ограниченной растворимостью в жидкой фазе (расслаивающиеся жидкости)
|
|
|
|
Многие жидкости обладают ограниченной взаимной растворимостью друг в друге и в определенном интервале температур и составов образуют два жидких слоя (две жидких фазы). Диаграммы состояния таких систем строят в координатах «температура – состав». Все диаграммы такого рода можно свести к трем типам.
Первый тип – диаграммы с верхней температурой взаиморастворения (Т ВВ) или диаграммы с верхней критической точкой.
Кривая на диаграмме называется кривой расслоения. Рассмотрим фазовые равновесия в системе «анилин – вода» (рис. 44) при произвольной температуре Т ´.

Рис. 44. Диаграмма с верхней температурой взаиморастворения (система «анилин – вода»)
В системе при ω<ω m анилин полностью растворяется в воде, число фаз в ней равно 1, число степеней свободы: С = 2 – 1 + 1 = 2, следовательно, произвольно в определенных пределах можно изменять два параметра: температуру и концентрацию, а система по-прежнему будет оставаться однофазной. Когда концентрация анилина достигает значения ω m, в системе образуется вторая фаза – тоже раствор анилина в воде, но концентрация его ω n. При этом масса первого раствора гораздо больше, чем масса второго. При дальнейшем добавлении в систему анилина концентрации растворов изменяться не будут, но будут изменяться относительные массы фаз. Число степеней свободы такой системы С = 2 – 2 + 0 = 0 (n = 0, так как система рассматривается при постоянной температуре Т ´). Следовательно, при изменении состава всей системы в целом составы соответствующих фаз измениться не могут. Относительные массы сосуществующих фаз находят по правилу рычага. Отношение масс сосуществующих фаз в системе, которая описывается фигуративной точкой а, будет равно:
|
|
|
 , ,
| (148) |
где длина отрезков an и ma измеряется в миллиметрах или сантиметрах по диаграмме.
С повышением температуры область сосуществования двух фаз сокращается и выше точки K при любых соотношениях вода – анилин образуют раствор, становятся неограниченно растворимыми друг в друге. Эта температура называется верхней температурой взаиморастворения (Т ВВ) или верхней критической точкой.
Таким образом, если фигуративная точка, описывающая данную систему, лежит на кривой расслоения или внутри области, ограниченной ею (заштрихованная), то система состоит из двух жидких растворов. Чтобы найти состав сосуществующих фаз, через данную фигуративную точку надо провести горизонталь до пересечения с обеими ветвями кривой расслоения; перпендикуляры, опущенные из точек пересечения, укажут составы сосуществующих фаз (рис. 44).
Второй тип – диаграммы с нижней температурой взаиморастворения (Т НВ) или диаграммы с нижней критической точкой – представлен на рисунке 45. Примером такой системы является «триэтиламин (С2Н5)3N – Н2О».
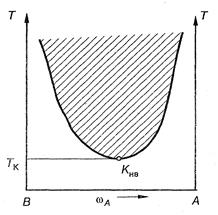
Рис. 45. Диаграмма с нижней температурой
взаиморастворения
Третий тип – диаграммы с верхней и нижней температурами взаиморастворения или диаграммы с нижней и верхней критической точкой – представлены на рисунке 46. Примером такой системы является «никотин – вода», Т ВВ= 483 К; Т НВ = 334 К.
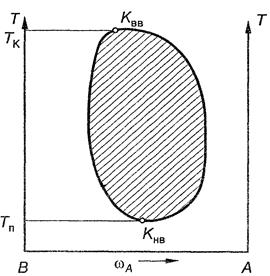
Рис. 46. Диаграмма с верхней и нижней температурой взаиморастворения системы «никотин – вода»
Анализ диаграммы второго и третьего типов проводится точно так же, как и анализ диаграмм первого типа.
Перегонка с водяным паром
Для очистки органических веществ, легко разлагающихся при нагревании до температуры их кипения, применяют метод перегонки с водяным паром. Для этого перегоняемую жидкость кипятят с водой или пропускают через нее водяной пар. Тогда перегонка идет при температуре ниже 100°С. В приемнике конденсат, содержащий оба компонента, расслаивается на воду и органическую жидкость (практически чистую). Далее органический слой отделяют и высушивают. Массовую долю каждой жидкости в конденсате рассчитывают по формулам:
|
|
|
 , ,
| (149) |
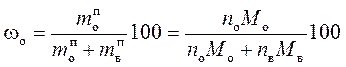 , ,
| (150) |
где wв, wо – содержание воды и органической жидкости в паре, мас. Доли, %;  ,
, 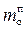 – содержание воды и органической жидкости в паре, г; n в, n о – число молей воды и органической жидкости в паре; М в, М о – молярные массы воды и органической жидкости;
– содержание воды и органической жидкости в паре, г; n в, n о – число молей воды и органической жидкости в паре; М в, М о – молярные массы воды и органической жидкости;
 , ,
| (151) |
или
 . .
| (152) |
Из уравнения (152) можно заключить, что состав паровой фазы над взаимно нерастворимыми жидкостями не зависит от массы жидкостей, а массовая доля перегоняемой жидкости в паре будет тем больше, чем меньше молярная масса и давление пара второй жидкости. Поэтому второй жидкостью обычно служит вода с относительно высокой температурой кипения 100°С и небольшой молярной массой 18 г/моль.
Отношение (151) к (152) дает выражение:
 , ,
| (153) |
в котором левая часть представляет собой расходный коэффициент пара. Он численно равен массе водяного пара, требуемой для перегонки одной единицы массы перегоняемого вещества. Расходный коэффициент пара тем больше, чем меньше давление насыщенного пара перегоняемой жидкости и чем меньше ее молярная масса.
|
|
|


