 |
Примеры решения типовых задач.
|
|
|
|
1. Константа равновесия  Kp реакции (все вещества газообразные) 2C5H12 + H2 2C4H10 + C2H6 при 100°С равна 1,46, а при 140°С – 0,54. Рассчитайте средний тепловой эффект этой реакции в данном интервале температур.
Kp реакции (все вещества газообразные) 2C5H12 + H2 2C4H10 + C2H6 при 100°С равна 1,46, а при 140°С – 0,54. Рассчитайте средний тепловой эффект этой реакции в данном интервале температур.
Решение:
 в химической реакции можно рассчитать с помощью интегральной формы уравнения изобары (уравнение (130))
в химической реакции можно рассчитать с помощью интегральной формы уравнения изобары (уравнение (130))

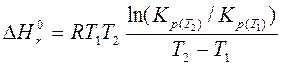

2. Для реакции
1/2 N2 + O2 NO2
зависимость константы равновесия от температуры выражается уравнением

Выведите уравнение зависимости  в этой реакции от температуры.
в этой реакции от температуры.
Решение:
Зависимость  в химической реакции от температуры можно рассчитать с помощью дифференциальной формы уравнения изобары
в химической реакции от температуры можно рассчитать с помощью дифференциальной формы уравнения изобары



 .
.
3. Определить константу равновесия  Kp реакции
Kp реакции
SO2 + 1/2O2 SO3
при 700 К, если  Kp = 588,9 при 500 К, а изменение энтальпии в реакции в этом диапазоне температур равно – 99,48 кДж
Kp = 588,9 при 500 К, а изменение энтальпии в реакции в этом диапазоне температур равно – 99,48 кДж
Решение:
Константу равновесия реакции при температуре T 2 можно рассчитать с помощью уравнения изобары в интегральной форме

если известна константа при температуре T 1 и изменение энтальпии  в реакции в этом диапазоне температур.
в реакции в этом диапазоне температур.


4. Рассчитать выход HI в реакции
H2 + I2 2HI
при температуре 400 К, если константа равновесия равна 2,40, а в исходной смеси было 5 моль H2 и 1,5 моль I2.
Решение:
Из уравнения реакции следует, что иод взят в недостатке. Максимальное количество иодоводорода, которое может быть получено при условии, что весь иод прореагирует, равно 3 моль. Пусть x – количество иода, вступившего в реакцию к моменту наступления равновесия. Расчеты оформим в виде таблицы. Уравнение для константы равновесия данной реакции имеет вид
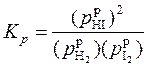
| Вещество | H2 | I2 | HI |
| Исходное количество | 1,5 | ||
| Прореагировало / образовалось | x | x | 2 x |
| Равновесное количество | 5 – x | 1,5 – x | 2 x |
Замена давлений pi на количества веществ ni (pi = niRT / V) приводит к уравнению
|
|
|

После подстановки равновесных значений количеств и значения константы в уравнение получим



Решая квадратное уравнение, получим

 ;
;  – не соответствует условию.
– не соответствует условию.
Количество иодоводорода в равновесии равно

Выход иодоводорода равен

5. Рассчитать степень диссоциации N2O4 в реакции
N2O4 2NO2
при температуре 298 К и давлении 101,3 кПа, если константа равновесия  Kp = 0,0970 атм.
Kp = 0,0970 атм.
Решение:
Уравнение для константы равновесия данной реакции имеет вид (давления выражены в атм)

Пусть a – степень диссоциации N2O4; рассчитаем равновесные давления обоих веществ:
| Вещество | N2O4 | NO2 |
| Исходное количество | n 0 | |
| Прореагировало / образовалось | a n 0 | 2a n 0 |
| Равновесное количество | (1 – a) n 0 | 2a n 0 |
| Молярные доли | 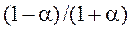
| 
|
Равновесные давления веществ равны
 ;
; 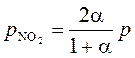
 ;
; 

Задачи для самостоятельного решения
1. Для реакции I2 2I приводятся константы равновесия при нескольких температурах:
| Т, К | ||||
 Kр ×103 Kр ×103
| 1,134 | 7,316 | 33,83 | 127,1 |
Постройте график зависимости  ln Kр от 1/ Т и определите
ln Kр от 1/ Т и определите  реакции.
реакции.
(Ответ: 150,0 кДж)
2. Для реакции C6H6(г) + 3H2 C6H12 (г) зависимость константы равновесия от температуры выражается уравнением
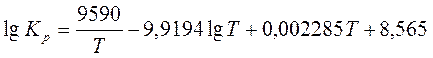
Выведите уравнение зависимости  в этой реакции от температуры и рассчитайте
в этой реакции от температуры и рассчитайте  .
.
(Ответ: –204,3 кДж)
3. Для реакции SO2 + 1/2O2 SO3 константа равновесия  Kр при 900 К равна 0,043×10–2, а при 950 К – 1,062×10–2. Определите
Kр при 900 К равна 0,043×10–2, а при 950 К – 1,062×10–2. Определите  Kр при 930 К. Примите, что тепловой эффект в температурном диапазоне 900 – 950 К постоянен.
Kр при 930 К. Примите, что тепловой эффект в температурном диапазоне 900 – 950 К постоянен.
(Ответ:  Kp = 3,1×10–3)
Kp = 3,1×10–3)
4. Для реакции цис -C5H10(г) + 2H2 C3H8(г) + C2H6(г) протекающей в газовой фазе, при температуре 750 К известна константа равновесия  Kр = 3,343 атм–1. Рассчитайте выход продуктов, если давление равно 5 атм, исходное количество циклопентана равно 1,2 моль, а водорода – 2,4 моль.
Kр = 3,343 атм–1. Рассчитайте выход продуктов, если давление равно 5 атм, исходное количество циклопентана равно 1,2 моль, а водорода – 2,4 моль.
(Ответ: 73,6%)
МОДУЛЬ 2
ХИМИЧЕСКОЕ РАВНОВЕСИЕ. ФАЗОВЫЕ РАВНОВЕСИЯ
|
|
|
|
|
|


