 |
Термодинамика разбавленных растворов, взаимосвязь между коллигативными свойствами
|
|
|
|
Коллигативными свойствами называются такие свойства разбавленных растворов, которые не зависят от природы частиц растворенного вещества, а зависят только от концентрации частиц в растворе.
К таким свойствам относят:
− понижение давления насыщенного пара растворителя над раствором по сравнению с чистым растворителем;
− осмос и осмотическое давление;
− понижение температуры кристаллизации растворителя из раствора по сравнению с чистым растворителем;
− повышение температуры кипения раствора по сравнению с чистым растворителем.
Коллигативные свойства растворов играют важную роль в биологии, медицине и фармации. Например, действие слабительных средств – горькой соли MgSO4 7Н2О и глауберовой соли Na2SO4 10H2O основано на явлении осмоса. Эти соли плохо всасываются через стенки кишечника, поэтому они создают в нем гипертоническую среду и вызывают поступление в кишечник большого количества воды через его стенки, что приводит к послабляющему действию.
Осмос и осмотическое давление играют существенную роль в жизни растений и живых организмов. Так, оболочка клеток выполняет роль полупроницаемой мембраны. Нарушение величины осмотического давления в организме ведет к нежелательным последствиям. Понижение осмотического давления при введении большого количества воды или в результате потери солей (например, с потом) вызывает рвоту, судороги и может в тяжелых случаях привести к гибели организма. Введение больших количеств солей приводит к перераспределению воды и к повышению осмотического давления, в результате чего в тканях скапливается избыток солей и возникают отеки.
Осмотическое давление является одной из причин движения воды в растениях и ее подъема от корней к листьям. С поверхности листьев растений вода испаряется; ее потери компенсируются осмотическим всасыванием из клеток стебля, которые в свою очередь пополняют запасы воды за счет осмоса из корневой системы.
|
|
|
Давление пара растворителя над разбавленными растворами. Закон Рауля
Основные уравнения
Наиболее простыми уравнениями описываются свойства идеальных растворов. Идеальными растворами называют растворы, образованные компонентами, у которых силы взаимодействия между молекулами одного и того же компонента такие же, как и между молекулами разных компонентов. В неидеальных растворах, к которым относится большинство растворов, силы взаимодействия между молекулами одного и того же и разных компонентов различны.
Для идеальных растворов выполняется закон Рауля:
v при постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
 , ,
| (162) |
где 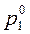 и
и  – давления насыщенного пара растворителя над чистым растворителем и над раствором соответственно; x 2 – мольная доля растворенного вещества.
– давления насыщенного пара растворителя над чистым растворителем и над раствором соответственно; x 2 – мольная доля растворенного вещества.
Переходя в уравнении (162) к мольной доле растворителя x 2 = 1 – x 1, получим другую форму уравнения Рауля:
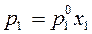 , ,
| (163) |
Переходя в уравнении (162) к количествам растворителя и растворенного вещества:
 , ,
| (164) |
получим:
 , ,
| (165) |
где n 1– число молей растворителя; n 2 – число молей растворенного вещества.
В неидеальном растворе при достаточно низкой концентрации растворенного вещества (этот случай соответствует так называемому "бесконечно разбавленному раствору") растворитель ведет себя как идеальный, для него закон Рауля выполняется так же, как и для идеального раствора.
Согласно закону Рауля, относительное понижение давления насыщенного пара растворителя не зависит от природы растворенного нелетучего вещества, а зависит только от его мольной доли.
|
|
|
Для учета процессов электролитической диссоциации и ассоциации молекул в растворах Вант-Гофф предложил использовать изотонический коэффициент i:
 , ,
| (166) |
или с учетом степени диссоциации электролита:
 , ,
| (167) |
где 
 – суммарное количество частиц (ионов и молекул) в растворе, моль; n исх – количество исходных молекул электролита, моль; a – степень диссоциации электролита; v – число ионов, на которые диссоциирует молекула электролита.
– суммарное количество частиц (ионов и молекул) в растворе, моль; n исх – количество исходных молекул электролита, моль; a – степень диссоциации электролита; v – число ионов, на которые диссоциирует молекула электролита.
Для растворов неэлектролитов, молекулы которых не диссоциируют и не ассоциируют, i = 1. Для водных растворов электролитов вследствие диссоциации i > 1, причем максимальное его значение при полной диссоциации для данного электролита равно числу ионов в его молекуле (imax = v):
| NaCl | CaCl2 | Na3PO4 | Al2(SO4)3 | |
| imax |
Для растворов, в которых вещество находится в виде ассоциатов, i < 1. Для растворов белков и высокомолекулярных веществ величина i зависит от концентрации и природы этих веществ.
С учетом изотонического коэффициента уравнения (162) и (165) закона Рауля приобретают вид:
 , ,
| (168) |
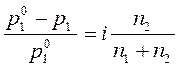 . .
| (169) |
Итак, для электролитов i > 1, для неэлектролитов i = 1, для веществ, образующих ассоциаты i < 1.
Примеры решения задач
1. Вычислить давление пара над раствором, содержащим 34,23 г сахарозы С12Н22О11 в 45,05 г воды при 65°С, если давление паров воды при этой же температуре равно 2,51×104 Па.
Решение:
Рассчитаем количество молей воды и сахарозы в растворе:
М (Н2О) = 18,02 г/моль; М (С12Н22О11) = 342,30 г/моль.


Давление насыщенного пара воды над раствором рассчитаем из уравнения (165) закона Рауля
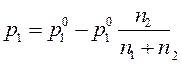

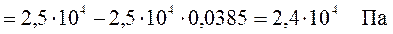
2. Рассчитать молярную массу неэлектролита, если 28,5 г этого вещества, растворенного в 785 г воды, вызывают понижение давления пара воды над раствором на 52,37 Па при 40°С. Давление водяного пара при этой температуре равно 7375,9 Па.
Решение:
Рассчитаем количество растворителя и растворенного вещества в растворе


здесь mx – масса неэлектролита, молярная масса которого равна Mx г/моль. Подставим давления паров и рассчитанные количества в уравнение (165) закона Рауля
 ;
;  ; 0,309 Mx + 0,202 = 28,5; Mx = 91,58 г/моль
; 0,309 Mx + 0,202 = 28,5; Mx = 91,58 г/моль
3. Давление водяного пара над раствором 24,8 г KCl в 100 г Н2О при 100°С равно 9,14×104 Па. Вычислить изотонический коэффициент, если давление водяного пара над чистой водой при этой температуре равно 1,0133×105 Па.
|
|
|
Решение:
Рассчитаем количества молей воды и хлорида калия
М (KCl) = 74,56 г/моль
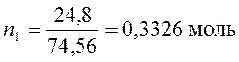
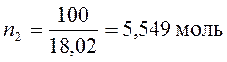
Применим уравнение (169) закона Рауля для расчета изотонического коэффициента хлорида калия

|
|
|


