 |
Примеры решения типовых задач.
|
|
|
|
1. При 823 К и 1,0133×105 Па степень диссоциации фосгена
СОCl2(г) = CO(г) + Cl2(г)
на оксид углерода(II) и хлор равна 77%. Определите Kр.
Решение:
По закону Дальтона парциальное давление газообразного вещества pj пропорционально его молярной доле xj и общему давлению р:
 ,
,
где nj – количество газообразного вещества;  – суммарное количество всех газообразных веществ.
– суммарное количество всех газообразных веществ.
Пусть начальное количество фосгена равно 1 моль и вначале оксид углерода(II) и хлор отсутствовали в смеси. Обозначим степень диссоциации a, тогда
| Вещество | СОCl2 | CO | Cl2 |
| Исходное количество | |||
| Прореагировало / образовалось | a | a | a |
| Равновесное количество | 1 – a | a | a |
| Молярные доли | 
| 
| 
|
Равновесные давления веществ равны:
р (СО) = р (Cl2) =  , р (СОCl2) =
, р (СОCl2) = 
Константа равновесия этой реакции равна:

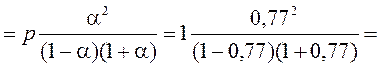

2. Определить направление самопроизвольного протекания реакции
2Cl2(г) + 2H2O(г) 4HCl(г) + О2(г)
при смешении по 1 моль Cl2, O2, HCl и 2 моль Н2О (все вещества – газы) при 1000 К и 1,033×105 Па, если lg Kр = 7,8.
Решение:
По закону Дальтона парциальное давление газообразного вещества pj пропорционально его мольной доле и общему давлению р:
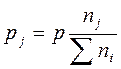 ,
,
где nj – количество газообразного вещества;  – суммарное количество всех газообразных веществ.
– суммарное количество всех газообразных веществ.
 = 1 моль Сl2 + 1 моль О2 + 1 моль HCl +
= 1 моль Сl2 + 1 моль О2 + 1 моль HCl +
+ 2 моль Н2О = 5 моль


= – 174,3 кДж/моль.
Реакция будет самопроизвольно протекать в прямом направлении.
3. Определить константу равновесия реакции
Al2O3(т)+ 3SO3(г) = Al2(SO4)3(т)
при температуре 298 К, пользуясь таблицами термодинамических величин.
Решение: (Вариант 1)
Найдем в таблицах  и
и  :
:
| Вещество | Al2(SO4)3 | Al2O3 | SO3 |
 , кДж/моль , кДж/моль
| – 3441,80 | – 1675,69 | – 395,85 |
 , Дж/(моль×К) , Дж/(моль×К)
| 239,20 | 50,92 | 256,69 |

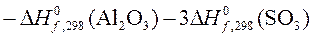
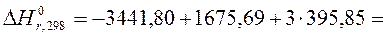
 .
.

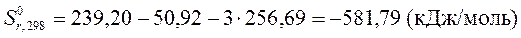 .
.

 .
.


Решение: (Вариант 2)
|
|
|
Найдем в таблицах  :
:
| Вещество | Al2(SO4)3 | Al2O3 | SO3 |
 , кДж/моль , кДж/моль
| – 3100,87 | – 1582,27 | – 371,17 |
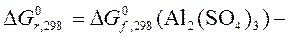


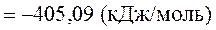 .
.

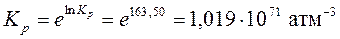
Задачи для самостоятельного решения
1. Для реакции Н3РО4 + аденозин АМФ + Н2О  = 14 кДж/моль. В каком направлении реакция идет самопроизвольно при этих условиях? Рассчитайте константу равновесия.
= 14 кДж/моль. В каком направлении реакция идет самопроизвольно при этих условиях? Рассчитайте константу равновесия.
(Ответ: справа налево; Kp = 4,37×10–3)
2. Рассчитать константу равновесия Kр реакции
1/2 N2O4 NO2,
если степень диссоциации равна 0,533, а давление 5,49×104 Па при температуре 323 К.
(Ответ: Kp = 295,2 Па0,5)
3. Определите направление самопроизвольного протекания реакции
CH3OH(г) HCHO(г) + 1/2H2 (г)
при стандартных условиях, пользуясь таблицами термодинамических данных.
(Ответ: D G = 52,44 кДж/моль; справа налево)
4. Константа равновесия реакции
С2Н4 + Н2 С2Н6
при температуре 298 равна 10 кПа–1. В каком направлении в изобарных условиях будет протекать эта реакция при этой температуре и следующих начальных парциальных давлениях веществ: этилен – 1 кПа, водород – 2 кПа, этан – 3 кПа?
(Ответ: D G = –4,7 кДж/моль; слева направо)
5. Рассчитать константу равновесия реакции образования метанола
СО(г) + 2Н2(г) СН3ОН(г)
при стандартных условиях, пользуясь таблицами термодинамических величин.
(Ответ: Kp = 26,5×103)
Зависимость констант равновесия реакций от температуры. Расчет равновесного выхода продуктов реакции
Основные уравнения
Уравнение изобары Вант-Гоффа (дифференциальная форма):

| (127) |
и уравнение изохоры Вант-Гоффа (дифференциальная форма):

| (128) |
передают зависимость констант равновесия химической реакции от температуры.
Величины  и
и 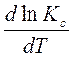 называют температурными коэффициентами логарифма константы химического равновесия, то есть изменением
называют температурными коэффициентами логарифма константы химического равновесия, то есть изменением  и
и  с изменением температуры на единицу.
с изменением температуры на единицу.
В простейшем случае, если считать тепловой эффект в интервале температур от Т 1 до Т 2 постоянным, константу равновесия можно рассчитать с помощью интегральной формы уравнения изобары:
|
|
|

| (129) |

| (130) |
или изохоры

| (131) |
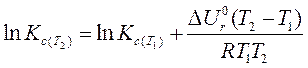
| (132) |
где  ,
,  и
и  ,
,  – константы равновесия при температурах Т 2 и Т 1соответственно.
– константы равновесия при температурах Т 2 и Т 1соответственно.
Уравнения (129) и (130) можно переписать и в другой форме:

| (133) |

| (134) |
Из такой формы уравнений следует, что зависимость ln Kc от 1/ T, имеет линейный вид. В таких координатах по графику, который построен по экспериментальным данным, можно рассчитать  и
и  .
.
Расчет равновесного выхода продуктов реакциипри некоторой температуре и постоянном давлении (или объеме) проводится с помощью уравнения для константы равновесия  (или
(или  ) соответствующей реакции. Для этих условий должно быть известно значение константы равновесия и начальные количества всех реагентов и продуктов реакции. Обозначают через х количество вещества, которое вступает в реакцию к моменту наступления равновесия (в качестве этого вещества удобно выбрать то, которое в уравнении реакции имеет стехиометрический коэффициент, равный единице). Далее выражают через x давления (концентрации) всех реагентов и продуктов реакции. Полученное таким образом уравнение решают относительно х аналитическим, графическим или численным методом.
) соответствующей реакции. Для этих условий должно быть известно значение константы равновесия и начальные количества всех реагентов и продуктов реакции. Обозначают через х количество вещества, которое вступает в реакцию к моменту наступления равновесия (в качестве этого вещества удобно выбрать то, которое в уравнении реакции имеет стехиометрический коэффициент, равный единице). Далее выражают через x давления (концентрации) всех реагентов и продуктов реакции. Полученное таким образом уравнение решают относительно х аналитическим, графическим или численным методом.
|
|
|


