 |
Фазовые равновесия в трехкомпонентных системах. Экстракция
|
|
|
|
Если в систему, состоящую из двух взаимно нерастворимых жидкостей, добавить третий компонент, то он распределится в них в определенном соотношении. Например, если в сосуд, содержащий водный и хлороформный слои, добавить иод, то он будет растворяться в воде и хлороформе до тех пор, пока не установится динамическое равновесие между фазами.
Отношение равновесных концентраций 3-го компонента в двух взаимно нерастворимых жидкостях при постоянной температуре называется коэффициентом распределения. Принято выражать коэффициент распределения отношением равновесной концентрации распределяемого вещества в органической фазе ( ) к его концентрации в водной фазе (
) к его концентрации в водной фазе (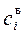 ):
):
 . .
| (154) |
В фармации для извлечения из растительного сырья эфирных масел, алкалоидов и других физиологически активных веществ широко применяют экстракцию.
Экстракция может быть однократной, когда экстрагент добавляется в один прием, и дробной – добавление экстрагента проводится порциями в несколько приемов. После добавления экстрагента, встряхивания и отстаивания проводят разделение фаз и определяют массу извлеченного вещества каким-либо аналитическим или физико-химическим методом.
Допустим, что в водном растворе, объем которого V 1 л, содержится m 0 кг вещества, извлекаемого однократно органическим экстрагентом, объем которого V 2 м3. После перехода в экстрагент массы m 0 вещества устанавливается равновесие и масса вещества, оставшаяся неизвлеченной в результате однократной экстракции равна:
 . .
| (155) |
Аналогичное уравнение для дробной экстракции имеет вид:
 , ,
| (156) |
где mn – масса неизвлеченного вещества после п экстракций; V 2/ n – объем порции экстрагента; п – число экстракций.
|
|
|
Уравнения (155) и (156) можно представить в более удобной для расчетов форме. Обозначив отношение объемов органической и водной фаз через  V р (V р = V 2/ V 1) и проведя простейшие преобразования, получим для однократной экстракции:
V р (V р = V 2/ V 1) и проведя простейшие преобразования, получим для однократной экстракции:
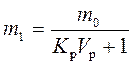 , ,
| (157) |
для дробной экстракции
 . .
| (158) |
С помощью уравнений (155) – (158) рассчитывают теоретически возможную массу извлекаемого вещества как т 0 – m 1 и т 0 – mn. Степень извлечения (%) при однократной экстракции:
 , ,
| (159) |
при дробной экстракции
 , ,
| (160) |
где т э и т¢э – экспериментально найденная масса извлеченного вещества при однократной и многократной экстракции соответственно.
После преобразования уравнения (158) получают уравнение:
 , ,
| (161) |
которое позволяет определить число экстракций п, необходимое для заданной полноты извлечения экстрагируемого вещества, а также оценить степень извлечения (т э /т 0) при выбранном числе экстракций.
В фармации известен и широко применяется термин «несовместимость». Под несовместимостью подразумевают процесс, изменяющий первоначальные химические, физические и фармакодинамические свойства лекарственных препаратов и приводящий к ухудшению их качества. Пользуясь диаграммами состояния, можно предусмотреть и устранить «несовместимость физическую» (отсыревание порошков, расслоение эмульсий) и «несовместимость химическую» (взаимодействие между компонентами с образованием новых соединений). Установлено, что физическая несовместимость связана с образованием эвтектики. Эвтектические смеси образуют анестезин с ризорцином, антипирин с фенацетином, ацетилсалициловая кислота с амидопирином и др. Отсыревание наблюдается уже в момент приготовления лекарственных форм. Это объясняется тем, что температура плавления эвтектической смеси значительно ниже температур плавления чистых компонентов.
Образование эвтектической смеси может приводить и к улучшению качества лекарств. Например, при изготовлении присыпки из тимола и ментола эвтектическая смесь состоит из более мелких частичек, чем смесь из тех же веществ, но отличающаяся по составу от эвтектической. Это приводит к равномерному распределению компонентов в лекарственной форме.
|
|
|
С уменьшением размера частиц в эвтектических смесях увеличивается биологическая доступность малорастворимых веществ. В ряде случаев диаграммы состояния лекарственных смесей помогают приготовить лекарственную форму. Например, без диаграммы состояния затруднителен выбор основы для приготовления суппозиториев (медицинских свечей). Необходима такая жировая основа, при которой свечи плавятся при температуре 35 – 36ºС (температура тела) и не размягчаются при температуре ниже 32ºС. Диаграмма состояния показывает, что указанным требованиям удовлетворяют смеси: 40% саломаса и 60% метилстеарата; 80% парафина и 20% метилстеарата.
 Примеры решения типовых задач
Примеры решения типовых задач
1. Охарактеризуйте представленную диаграмму. Опишите точку О системы. Рассчитайте состав исходной системы в граммах компонентов при 348 К, если масса исходной смеси 1 кг.
Решение:
Представленная диаграмма плавкости смеси твердых веществ А и В, которые неограниченно растворимы в жидком состоянии, а в твердом не образуют на химических соединений, ни растворов.
Т плА = 95ºС (368 К), Т плВ = 60ºС (333 К).
Координаты эвтектической точки: состав 20% масс. А и 80% масс. В, температура 45ºС (318 К). Система получена смешением твердых веществ А и В в соотношении: состав 60% масс. А и 40% масс. В или 400 г В и 600 г А. Исходная смесь начнет плавиться при 45ºС (точка М), при этом образуется жидкий раствор состава 20% масс. А и 80% масс. В (эвтектический, соответствует точке Э). При охлаждении расплава до 45ºС – это температура конца кристаллизации. Исходная смесь закончит плавиться при 80ºС. При температуре выше, чем указанная, система однофазна, агрегатное состояние – жидкость. При охлаждении расплава до 80ºС – это температура начала кристаллизации. Первым кристаллизуется компонент А (линия xy). При нагреве исходной смеси до 75ºС (348 К) образуется гетерогенная система, состоящая из двух фаз.
Агрегатное состояние равновесных фаз: твердое и жидкое. Состав равновесных фаз (линия тж): 50% масс. А и 50% масс. В – состав жидкой фазы, 100% масс. А – состав твердой фазы. Соотношение масс равновесных фаз (по правилу рычага):
|
|
|
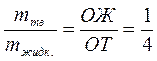
Растворимость А в В: не более 50% масс. Число степеней свободы (по правилу Гиббса): С = 2 – 2 + 1 (независимая переменная – температура).
При температуре 348 К исходная смесь состоит из твердой и жидкой фаз, соотношение масс которых 1:4 (общая масса 1 кг).
1 кг – это масса, приходящаяся на 5 частей системы (1 + 4 = 5),
х кг – это масса, приходящаяся на 1 часть системы, на твердую часть системы, состав которой 100% масс. А.
Из пропорции находим, что х = 200 г, т.е. в твердой фазе 200 г вещества А.
1000 г – 200 г = 800 г – масса жидкой фазы, состав которой 50% масс. А и 50% масс. В. Следовательно, в жидкой фазе 400 г А и 400 г В.
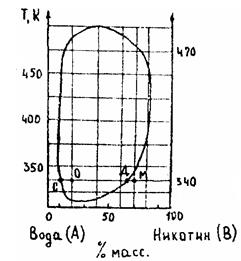
2. Охарактеризуйте представленную диаграмму. Опишите систему, полученную в результате смешения 140 г никотина (В) с 60 г воды (А) и нагрева смеси до 340 К. Укажите возможные изменения при повышении температуры до 500 К. К исходной смеси добавили 500 г воды. Сравните вновь полученную систему с исходной при 340 К.
Решение:
Данная диаграмма – это диаграмма двухкомпонентной системы с ограниченной растворимостью в жидкой фазе с верхней и нижней критической температурой.
Верхняя критическая температура – 490 К. Выше нее жидкости неограниченно смешиваются друг с другом (смешиваются в любых соотношениях).
Нижняя критическая температура – 310 К. Ниже нее жидкости неограниченно смешиваются друг с другом (образуют гомогенную бинарную систему).
Состав смеси в %масс.: 30% А (60 г) и 70% В (140 г).
При 340 К (67ºС) исходная смесь представляет собой раствор (точка М) воды в никотине.
При повышении температуры до 350 К появляется вторая жидкая фаза – раствор никотина в воде, система становится гетерогенной.
В интервале температур 350 – 470 К исходная смесь воды и никотина представляет собой гетерогенную систему из двух жидких фаз. При температуре выше 470 К смесь вновь становится гомогенной.
Состав полученной смеси в г: 560 г А и 140 г В. Состав этой смеси в %масс.: 80% А (воды) и 20% В (никотина).
|
|
|
При 340 К смесь такого состава представляет собой гетерогенную систему (точка О), состоящую из двух жидких фаз С и Д (точка С и точка Д).
Состав равновесных жидких фаз С и Д (по конноде СД):
состав фазы С, %масс.: 10% никотина (В) и 90% воды (А) – раствор никотина в воде;
состав фазы Д, %масс.: 65% никотина (В) и 35% воды (А) – раствор воды в никотине.
Соотношение масс равновесных фаз (по правилу рычага):

(700 – общая масса смеси, г).
Решая уравнение  , получаем: масса жидкой фазы равна 572,7 г, а масса жидкой фазы Д – 127,3 г.
, получаем: масса жидкой фазы равна 572,7 г, а масса жидкой фазы Д – 127,3 г.
Состав равновесных фаз в граммах компонентов:
фаза С – 57,3 г (10%) никотина и 515,4 г (90%) воды;
фаза Д – 82,7 г (65%) никотина и 44,6 г (35%) воды.
3. Смесь камфоры и воды кипит при нормальном атмосферном давлении (101,3 кПа) при 99°С. Определить содержание камфоры и воды в конденсате (% масс.). Камфора практически нерастворима в воде и имеет молярную массу, равную 152,2 г/моль. Давление паров воды при 99°С равно 98 кПа.
Решение:
Согласно уравнению  давление паров камфоры при 99°С определяют по разности
давление паров камфоры при 99°С определяют по разности
 .
.
Содержание камфоры в конденсате рассчитывают по уравнению:
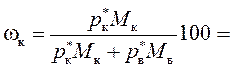

Содержание воды в конденсате находят по разности

4. Иод из 4 л водного раствора с концентрацией 0,1 г/л экстрагируют порциями по 100 мл сероуглерода при 25°С. Сколько иода останется неизвлеченным после первой экстракции? Сколько нужно провести экстракций, чтобы извлечь иод на 99%. Коэффициент распределения иода между сероуглеродом и водой равен 590.
Решение:
Находят исходную массу иода в водном растворе
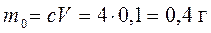
Остаток иода после первой экстракции равен
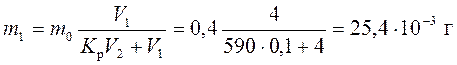
Остаток неизвлеченного иода после многократной экстракции равен
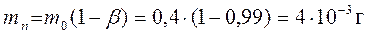
Остаток иода после многократной экстракции равен
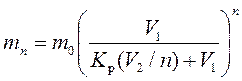
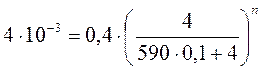
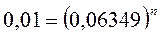
Логарифмируя это уравнение, найдем n
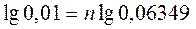

Для достижения необходимой степени извлечения нужно провести 2 экстракции.
|
|
|


