 |
Задачи для самостоятельного решения.
|
|
|
|
1. Давление пара диэтилового эфира над раствором, содержащим 155 г анилина С6Н5NH2 в 121 г диэтилового эфира, при некоторой температуре равно 42900 Па. Давление пара эфира над чистым эфиром при этой температуре равно 86380 Па. Рассчитать молярную массу диэтилового эфира.
(Ответ: 74 г/моль)
2. Давление водяного пара над чистой водой при 50°С равно 1,2334·104 Па. Вычислить давление водяного пара над раствором, содержащим 50 г этиленгликоля С2Н4(ОН)2 в 900 г воды.
(Ответ: 1,21·104 Па).
3. Давление насыщенного водяного пара над раствором неэлектролита при 80°С равно 33,310 кПа. Какое количество воды приходится на 1 моль растворенного вещества в этом растворе? Давление пара при этой температуре равно 47,375 кПа.
(Ответ: 2,4 моль).
4. Давление паров воды над чистой водой при 28,0°С равно 28,065 мм рт. ст. Давление паров воды над раствором, приготовленным из 100 г воды и 13 г нелетучего растворенного вещества, равно 27,371 мм рт. ст. Рассчитайте молярную массу этого вещества, считая раствор идеальным.
(Ответ: 92,3 г/моль).
5. Давление водяного пара над раствором, содержащем 66,6 г СаCl2 в 90,0 г Н2О, при 90°С равно 56690 Па. Чему равен изотонический коэффициент, если давление паров воды при этой же температуре равно 70101 Па?
(Ответ: 1,78).
6. Определите давление пара воды над водным раствором гидроксида калия (w = 0,5%) при 50°С. Давление пара воды при этой температуре равно 12334 Па. Кажущаяся степень диссоциации KОН в этом растворе равна 87%.
(Ответ: 12297 Па).
Осмотическое давление растворов
Основные уравнения
Поместим между двумя половинами сосуда (рис. 48) мембрану 1, которая проницаема для молекул растворителя и не пропускает молекулы растворенного вещества. В правую половину сосуда поместим раствор 2, а в левую половину – растворитель 3.
|
|
|
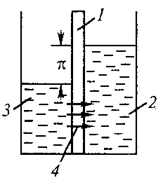
Рис. 48. Схема, поясняющая явление осмоса:
1 – полупроницаемая мембрана; 2 – раствор;
3 –растворитель; 4 – поток растворителя.
В такой системе из-за того, что химический потенциал (концентрация) растворителя слева от мембраны больше, а справа меньше, в результате диффузии начнется перенос растворителя из чистого растворителя в раствор. Такой процесс называется осмосом.
v Осмос – это самопроизвольный процесс переноса растворителя через полупроницаемую мембрану из растворителя в раствор или из менее концентрированного раствора в более концентрированный.
Если к раствору, расположенному справа от мембраны, приложить избыточное давление, то это приведет к увеличению химического потенциала растворителя справа от мембраны, уменьшению разности химических потенциалов растворителя слева и справа от мембраны и уменьшению потока растворителя через мембрану. При некотором значении избыточного давления поток растворителя уменьшится до нуля.
v Осмотическим давлением (p осм) называют такое избыточное внешнее давление, которое необходимо приложить к раствору, чтобы предотвратить осмотический перенос растворителя в раствор через полупроницаемую мембрану.
Вант-Гофф для объяснения зависимости осмотического давления разбавленных растворов от их концентрации предложил уравнение:
 , ,
| (170) |
где p осм – осмотическое давление раствора, кПа (или Па); с 2 – молярная концентрация растворенного вещества в растворе, моль/л (или моль/м3).
Уравнение Вант-Гоффа для осмотического давления по своему виду совпадает с уравнением состояния идеального газа Менделеева-Клапейрона, однако величина p осм имеет совсем другой смысл, чем обычное давление газа p.
Заменяя концентрацию с 2 выражением:
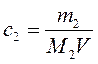 , ,
| (171) |
где m 2 – масса растворенного вещества; М 2– его молярная масса; V – объем раствора, получим:
|
|
|
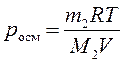 , ,
| (172) |
Уравнения (170) и (172) для осмотического давления так же, как и уравнения (162) и (165) закона Рауля, строго применимы только для идеальных растворов. С хорошей точностью они применимы в разбавленных растворах, в которых мольная доля растворенного вещества намного меньше мольной доли растворителя.
Расчет молярной массы растворенного вещества при использовании осмотического метода проводят по формуле:
 , ,
| (173) |
которую получают заменой моляльной концентрации вещества в уравнении (170) с помощью уравнения:
 . .
| (174) |
С учетом изотонического коэффициента уравнение (170) для осмотического давления для растворов электролитов приобретает вид:
 . .
| (175) |
Осмометрический метод применяют в основном для определения молярных масс высокомолекулярных соединений (белков, полисахаридов). Для этого достаточно измерить осмотическое давление раствора известной концентрации.
Примеры решения задач
1. Вычислить осмотическое давление раствора, содержащего 63,00 г глюкозы С6Н12О6 в 1,400 л раствора при 0°С.
Решение:
Рассчитаем количество глюкозы:

Так как глюкоза является неэлектролитом, то осмотическое давление ее раствора рассчитаем по уравнению Вант-Гоффа (172) без учета изотонического коэффициента:
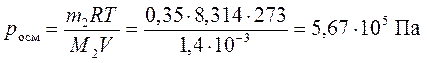
2. Определить молярную массу неэлектролита, если в 5 л раствора содержится 2,5 г неэлектролита. Осмотическое давление этого раствора равно 0,23×105 Па при температуре 20°С.
Решение:
Молярную массу растворенного вещества найдем, используя уравнение (172):
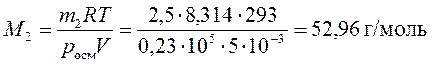
3. Вычислить осмотическое давление водного раствора сахарозы и давление водяного пара над раствором по следующим данным: T = 293 К; на 100 г воды приходится 6,84 г сахарозы; давление пара воды над чистой водой при 293 К равно 2,338 кПа. Молярная масса сахарозы 342,30 г/моль.
Решение:
Концентрация сахарозы в растворе равна:

Полагая, что раствор подчиняется законам предельно разбавленных растворов, рассчитаем осмотическое давление по уравнению (170)
р осм = 200×8,314×293 = 487200 Па = 0,4872 МПа
Рассчитаем мольную долю сахарозы в растворе
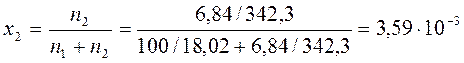
Давление водяного пара над раствором рассчитаем, используя уравнение (162)
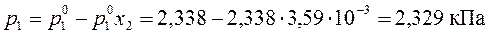 .
.
|
|
|


