 |
Задачи для самостоятельного решения.
|
|
|
|
1. Раствор, содержащий 0,162 г серы в 20 г бензола, кипит при температуре на 0,081° выше, чем чистый бензол. Рассчитайте молярную массу серы в растворе. Сколько атомов содержится в одной молекуле серы?
(Ответ: 264,0 г/моль; 8,25).
2. При какой температуре будет замерзать раствор, содержащий 500 г этиленгликоля С2Н4(ОН)2 в 4 л Н2О?
(Ответ: –3,73°С)
3. При какой температуре будет замерзать (начинать кристаллизоваться) водный раствор этилового спирта, если массовая доля w (С2Н5ОН) = 25%.
(Ответ: –13,4°С).
4. Изотонический коэффициент хлороводорода в его растворе с массовой долей w = 6,8% равен 1,66. Вычислите температуру замерзания (начала кристаллизации) этого раствора.
(Ответ: – 6,15°С).
5. Какова должна быть молярная концентрация водного раствора NaNO3, чтобы давление пара растворителя над этим раствором было такое же, как у водного раствора с массовой долей глицерина w = 1,5%.
(Ответ: 0,082 моль/кг).
6. Вычислите кажущуюся степень диссоциации хлорида калия в растворе, содержащем 4,47 г KCl в 100 г воды, если этот раствор замерзает (начинает кристаллизоваться) при –2°С.
(Ответ: 80 %).
7. Кажущаяся степень диссоциации гидроксида натрия в растворе, содержащем 4,1 г NaOH в 200 г воды, равна 88%. Определите температуру кипения этого раствора (K эб для воды равна 0,516°С).
(Ответ: 100,5°С).
8. Раствор, содержащий 14,62 г NaCl в 500 г воды, замерзает при –1,67°С. Вычислите кажущуюся степень диссоциации этого электролита в растворе и осмотическое давление раствора при 27°С. Плотность раствора 1000 кг/м3.
(Ответ: 80%, 21,8·105 Па).
9. Кажущаяся степень диссоциации KNO3 в растворе, содержащем 4,55 г KNO3 и 50 г воды, равна 70%. Во сколько раз повышение температуры кипения этого раствора больше повышения температуры кипения эквимолярного раствора неэлектролита?
|
|
|
(Ответ: 1,7 раза).
ТЕРМОДИНАМИКА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Одной из основных характеристик растворов электролитов является рН. Поддержание постоянства рН крови и других жидкостей организма – важнейшая функция любого живого организма.
При приготовлении жидких лекарственных форм для инъекций следует учитывать, что количество содержащихся в них кислот и оснований различной природы при внутривенном введении не должно приводить к отклонениям рН крови от нормы.
Кроме того, в качестве буферных систем, применяемых для приготовления лекарственных препаратов, должны использоваться лишь те, что имеются в организме – гидрокарбонатная, фосфатная, белковая, аминокислотная, гемоглобиновая системы.
Правильно выбранное значение рН и состав буферной системы способствует лучшему усвоению вводимого лекарственного средства и, как следствие, усилению лечебного эффекта.
Теория растворов сильных электролитов Дебая – Хюккеля
Основные уравнения
Теория сильных электролитов П.Дебая и Э.Хюккеля была создана для того, чтобы объяснить причины расхождений, которые появлялись при попытках применить теорию электролитической диссоциации С. Аррениуса к сильным электролитам. Так оказалось, что константы диссоциации сильных электролитов заметно зависели от их концентрации даже в разбавленных растворах, а это противоречило теории Аррениуса. Кроме того, степень диссоциации сильных электролитов, рассчитанная из коллигативных свойств, оказывалась меньше единицы, а это противоречило понятию ²сильный электролит².
В теории Аррениуса учитывается электростатическое притяжение и отталкивание ионов, а также их тепловое движение в растворе. В основу теории сильных электролитов положена идея о существовании вокруг каждого иона ионной атмосферы. Образование ионной атмосферы объясняется тем, что одноименно заряженные ионы взаимно отталкиваются, а разноименно заряженные – взаимно притягиваются. Ионная атмосфера содержит и положительные, и отрицательные ионы, однако в среднем вокруг каждого положительного иона имеется избыток отрицательных ионов, а вокруг каждого отрицательного – избыток положительных. В каждом случае выбранный центральный ион и его ионная атмосфера имеют заряды одинаковые по абсолютной величине. Плотность ионной атмосферы максимальна у центрального иона и с удалением от него уменьшается. Несмотря на то, что ионная атмосфера ²бесконечна² в математическом смысле, из уравнений теории следует величина, которая называется эффективным радиусом ионной атмосферы.
|
|
|
Радиус ионной атмосферы R и.а уменьшается с увеличением ионной силы раствора I и равен:
 , ,
| (184) |
где  – диэлектрическая проницаемость растворителя, которая показывает, во сколько раз притяжение или отталкивание между ионами меньше в растворителе, чем в вакууме; k Б = 1,3807×10–23 Дж/К – постоянная Больцмана; T – абсолютная температура; N А = 6,0220×1023 – постоянная Авогадро; e – заряд электрона; I – ионная сила раствора.
– диэлектрическая проницаемость растворителя, которая показывает, во сколько раз притяжение или отталкивание между ионами меньше в растворителе, чем в вакууме; k Б = 1,3807×10–23 Дж/К – постоянная Больцмана; T – абсолютная температура; N А = 6,0220×1023 – постоянная Авогадро; e – заряд электрона; I – ионная сила раствора.
v Ионная сила раствора – величина, характеризующая интенсивность электростатического поля всех ионов в растворе
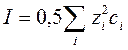 . .
| (185) |
Теория Дебая и Хюккеля позволяет по энергии электростатического взаимодействия центрального иона и его ионной атмосферы рассчитать коэффициент активности ионов электролита в растворе.
Активность связана с коэффициентом активности и концентрацией ионов в растворе уравнением:
 . .
| (186) |
Активность электролита  связана с активностям отдельных ионов уравнением:
связана с активностям отдельных ионов уравнением:
 . .
| (187) |
В разбавленных (с < 10–2 М) водных растворах 1,1-валентных электролитов, в которых расстояния между ионами велики, а энергия электростатического взаимодействия мала по сравнению тепловой энергией ионов, при температуре 298 К коэффициенты активности ионов (любых, независимо от их природы) зависят только от ионной силы раствора (уравнение первого приближения теории Дебая – Хюккеля):
 , ,
| (188) |
На практике удается измерять среднеионные коэффициенты активности, а не коэффициенты активности индивидуальных ионов. Для электролита  среднеионный коэффициент активности g ± связан с коэффициентами активности gi индивидуальных ионов уравнением:
среднеионный коэффициент активности g ± связан с коэффициентами активности gi индивидуальных ионов уравнением:
|
|
|
 , ,
| (189) |
где v = v+ + v–.
С учетом этого уравнения, уравнение (188) принимает вид:
 , ,
| (190) |
Из уравнений (188) и (190) следует, что в разбавленных растворах с увеличением ионной силы раствора, как коэффициент активности отдельного иона, так и среднеионный коэффициент активности уменьшается.
В растворе индивидуального электролита при увеличении его концентрации коэффициент активности иона вначале уменьшается из-за усиления межионного электростатического взаимодействия, а при концентрациях близких к 1 моль/л и выше, его значение начинает возрастать и может даже превышать 1, то есть активность ионов в растворе становится больше его истинной концентрации. Если в растворе находится несколько электролитов, то на величину коэффициента активности каждого иона влияют концентрации всех ионов в растворе.
Примеры решения задач
1. Рассчитайте ионную силу раствора K2SO4, молярность которого равна 0,02 моль/л.
Решение:
Рассчитаем ионную силу раствора по уравнению (185):

 моль/л
моль/л
2. При отравлениях цианидами внутривенно вводят 2%-ный раствор нитрита натрия (ρ = 1,011 г/мл). Вычислите коэффициент активности и активности ионов в этом растворе.
Решение:


Коэффициенты активности g + и g – рассчитаем по уравнению Дебая-Хюккеля. Так как в первом приближении теории не учитывается природа иона, а только абсолютная величина его заряда, то g+ = g–

Рассчитаем ионную силу раствора




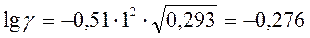

 моль/л
моль/л
|
|
|


