 |
Задачи для самостоятельного решения.
|
|
|
|
1. Рассчитать рН буферного раствора, приготовленного смешиванием 20 мл 0,2 М раствора Na2HPO4 и 50 мл 0,5 М раствора NaH2PO4. р Ka ( ) = 6,8.
) = 6,8.
(Ответ: 6,00).
2. Рассчитать рН раствора, полученного при смешивании 1,2 л 1,2 М раствора NH4OH и 0,6 л 0,6 М раствора NH4Cl. Kb (NH4OH) = 1,8·10–5.
(Ответ: 9,67).
3. Как изменится рН ацетатного буферного раствора (объем равен 1 л), содержащего 0,1 моль CH3COOH и 0,02 моль CH3COONa, при добавлении 0,01 моль HCl? Kа (CН3СООН) =1,75·10–5.
(Ответ: уменьшится на 0,342).
4. Рассчитать буферную емкость раствора по HCl, если при добавлении к 50 мл этого раствора 2 мл соляной кислоты с концентрацией 0,8 моль/л значение рН раствора изменяется от 7,36 до 7,00.
(Ответ: 0,085 моль/(л×ед. рН))
ЭЛЕКТРОХИМИЯ
Методы измерения электрической проводимости (прямая кондуктометрия и кондуктометрическое титрование) применяют для исследования свойств лекарственных препаратов и в контроле производства различных фармацевтических продуктов.
Кондуктометрию применяют для определения общего содержания электролитов в лечебных минеральных водах, продуктах детского, диетического и парентерального питания, растворах для внутривенного вливания.
Потенциометрия – один из наиболее широко применяемых в фармации методов. Он отличается высокой точностью, воспроизводимостью, быстротой определения, не требует дорогостоящего оборудования и реактивов.
В фармацевтическом анализе его используют при определении содержания цинка в лекарственных препаратах, железа в таблетированных формах и драже. Особенно часто применяют прямую потенциометрию (рН-метрию) для определения кислотности среды. Для определения ионов щелочных металлов и аммония используют электроды с поливинилхлоридными пластифицированными мембранами на основе антибиотиков (валиномицина, лазалоцида, нонактина).
|
|
|
Электропроводность растворов электролитов
Основные уравнения
v Электрохимия – раздел физической химии, в котором изучаются физико-химические свойства ионных систем (растворов, расплавов или твердых электролитов), а также явления, возникающие на границе двух фаз с участием заряженных частиц (ионов и электронов).
В гальваническом элементе одна из фаз – чаще всего металл или полупроводник, другая – раствор или расплав электролита.
Различают две основные группы проводников электрического тока: проводники первого рода – металлы, электрическая проводимость которых обусловлена электронами, и проводники второго рода, обладающие ионной проводимостью – растворы и расплавы электролитов.
Количественной характеристикой способности растворов проводить ток служит электрическая проводимость. Электрическая проводимость G представляет собой величину, обратную электрическому сопротивлению:
 . .
| (200) |
Размерностью электропроводности в системе СИ является См/м или Ом–1×м–1. Сопротивление проводника, имеющего простую форму (например, цилиндра или прямоугольной призмы), связано с его длиной и сечением уравнением:
 , ,
| (201) |
где ρ – удельное электрическое сопротивление, Ом·м; l – длина, м; S – площадь поперечного сечения, м2.
v Удельное электрическое сопротивление это сопротивление объема раствора, находящегося между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии 1 м друг от друга.
Отношение l / S называют константой кондуктометрической ячейки K яч:
 . .
| (202) |
Вводя в уравнение (201) константу ячейки, получим:
 , ,
| (203) |
или
 , ,
| (204) |
где k – удельная электрическая проводимость, См/м
| k = 1/ r. | (205) |
Переходя от сопротивления в уравнении (204) к электропроводности (200), получим:
|
|
|
 . .
| (206) |
Константу ячейки определяют, используя стандартный раствор (обычно KCl), удельная электропроводность которого известна (Приложение 12).
Для этого измеряют сопротивление или электропроводность такого стандартного раствора, а затем рассчитывают константу ячейки по формуле:
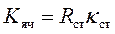
| (207) |
или
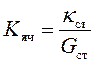 . .
| (208) |
Удельная электрическая проводимость k является характеристикой проводящей среды – раствора электролита.
v Удельная электрическая проводимость это электропроводность объема раствора, находящегося между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии 1 м друг от друга.
Удельная электрическая проводимость зависит от многих факторов, и, прежде всего, от природы электролита, его концентрации, температуры и природы растворителя (рис. 49).

Рис. 49. Зависимость удельной электропроводности от концентрации электролитов
При равных концентрациях и прочих равных условиях наибольшей является удельная электрическая проводимость растворов сильных кислот, меньше – растворов сильных оснований, еще меньше – других электролитов, особенно низкие значения удельной электропроводности имеют растворы слабых электролитов. Высокие значения электропроводности сильных кислот и щелочей объясняются особым механизмом переноса ионов водорода Н+ и гидроксила ОН– и, как следствие, более высокими подвижностями по сравнению с другими ионами (Приложение 13). В отличие от других ионов, движение ионов Н3О+ и ОН– в воде под влиянием электрического поля происходит не только за счет миграции (то есть движения в направлении поля вместе со своей гидратной оболочкой), но и эстафетным механизмом за счет перескока протонов от одной молекулы воды к другой в том же направлении. В разбавленных растворах электролитов эстафетный механизм переноса является преобладающим.
Схематически эстафетный перенос протонов по цепочке водородных связей между молекулами воды под действием электрического поля можно представить следующим образом:
| расстояние, на которое сместился протон | |

| |
| расстояние, на которое сместился электрический заряд | |

| |

| |
| до перескока H+ | после перескока H+ |
|
|
|
После перескока протона требуется некоторое время для того, чтобы молекулы воды развернулись на 180° в исходное положение. В этом случае вновь образуется цепочка молекул воды, по которой возможен перескок следующего протона. Скорость перемещения заряда за счет эстафетного механизма больше, чем скорость движения иона гидроксония с его гидратной оболочкой под действием электрического поля.
Перенос ионов гидроксила по цепочке водородных связей между молекулами воды под действием электрического поля также происходит по эстафетному механизму:
| расстояние, на которое сместился протон | |
| расстояние, на которое сместился электрический заряд | |

| |

| |
| до перескока H+ | после перескока H+ |
Удельная электрическая проводимость растворов электролитов растет с концентрацией (рис. 49) до некоторых максимальных значений, что отвечает увеличению числа ионов в единице объема раствора. Достигнув максимума, удельная электрическая проводимость снижается, несмотря на дальнейший рост концентрации электролита. Подобный характер зависимости связан у сильных электролитов с уменьшением подвижности ионов из-за возрастающего по мере увеличения концентрации раствора межионного взаимодействия, а у слабых электролитов – со снижением степени электролитической диссоциации, а значит, с уменьшением числа ионов в растворе.
С удельной электрической проводимостью электролита связана молярная электрическая проводимость λ:
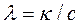 , ,
| (209) |
где l – молярная электрическая проводимость, Ом–1×м2×моль–1 или См·м2/моль; k – удельная электрическая проводимость, См×м–1; с – концентрация электролита в растворе, моль/м3.
v Молярная электрическая проводимость электролита (λ)равна удельной электрической проводимости его раствора с концентрацией 1 моль/м3.
Значение молярной электрической проводимости любого электролита при разбавлении раствора (при с → 0) увеличивается, стремясь к постоянной, характерной для каждого электролита величине, называемой предельной молярной электрической проводимостью и обозначаемой λ 0.
|
|
|
v Предельной молярной электрической проводимостью электролита (λ 0 ) называется значение его молярной электрической проводимости в бесконечно разбавленном растворе.
В случае сильных электролитов молярная электрическая проводимость электролита равна сумме молярных электропроводностей (или подвижностей) ионов:

| (210) |
или в бесконечно разбавленном растворе:
 . .
| (211) |
Для слабых электролитов это уравнение имеет другой вид:

| (212) |
или
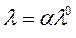
| (213) |
и является приближенным. Это связано с тем, что в теории Аррениуса (в которой вводится это уравнение) предполагалось, что молярные электропроводности не зависят от концентрации (то есть  ), а отличие
), а отличие  от
от  обусловлено только неполной диссоциацией электролита.
обусловлено только неполной диссоциацией электролита.
Уравнения (210) – (212) называются уравнениями Кольрауша, в соответствии с которыми, в растворе электролита катионы и анионы переносят электрический ток независимо друг от друга.
v Предельная молярная электрическая проводимость l 0 данного электролита равна сумме предельных молярных проводимостей ионов, входящих в его состав.
Для разбавленных растворов сильных 1,1-валентных электролитов Кольраушем было получено эмпирическое соотношение:

| (214) |
хорошо согласующееся с экспериментальными данными.
Это уравнение получило обоснование в теории Дебая – Хюккеля – Онзагера, в которой снижение молярной электропроводности (подвижности) иона и электролита в целом объясняется тормозящими эффектами ионной атмосферы: электрофоретическим и релаксационным.
Электрофоретический эффект связан с тем, что ион под действием внешнего электрического поля перемещается не в неподвижной среде, а в потоке движущихся ему навстречу противоионов.
Релаксационный эффект торможения обусловлен конечным временем разрушения (релаксации) ионной атмосферы. В результате этого центр ионной атмосферы в неравновесных условиях оказывается смещенным на некоторое расстояние от положения движущегося центрального иона. Таким образом, на центральный ион действует электростатическая возвращающая сила, которая и замедляет его движение.
Уравнения теории Дебая – Хюккеля – Онзагера для молярной подвижности отдельного иона:

| (215) |
и электролита в целом
 . .
| (216) |
по своему виду совпадают с уравнением (214) Кольрауша для зависимости молярной электропроводности электролита от концентрации. В водных растворах при температуре 25°С уравнение Дебая – Хюккеля – Онзагера (216) принимает вид:
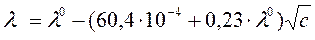 , ,
| (217) |
где размерность l – См·м2/моль, а размерность с – моль/л. Уравнение (217) применимо в еще более разбавленных растворах (с < 0,001), чем уравнение 1-го приближения теории Дебая – Хюккеля для коэффициента активности. Для расчета мольных электропроводностей электролитов в более широком диапазоне концентраций необходимо использовать справочные данные (Приложение 14).
|
|
|
Используя уравнение (213) Кольрауша для слабой одноосновной кислоты
HA H+ + А–
можно вывести уравнение, связывающее молярную электропроводность электролита и его концентрацию. Для этого, вводя в уравнение для константы диссоциации:

| (218) |
степень диссоциации, получим уравнение закона разбавления Оствальда:
 . .
| (219) |
Исключая из этого уравнения степень диссоциации, используя уравнение (213), получим:

| (220) |
или

| (221) |
Если степень диссоциации кислоты мала и 1 >> a, то уравнения (219) и (220) упрощаются:

| (222) |
и
 . .
| (223) |
Предельная подвижность иона является специфической величиной для данного вида ионов. Она зависит от заряда иона, радиуса сольватированного иона в растворе, а также природы растворителя, его вязкости и температуры и не зависит от природы другого иона в данном электролите:

| (224) |
где  – предельная молярная электрическая проводимость иона; e 0 – абсолютная величина заряда электрона; N A – число Авогадро; h – коэффициент динамической вязкости растворителя; ri – радиус сольватированного иона в растворе.
– предельная молярная электрическая проводимость иона; e 0 – абсолютная величина заряда электрона; N A – число Авогадро; h – коэффициент динамической вязкости растворителя; ri – радиус сольватированного иона в растворе.
Электрическая проводимость многих неводных растворов значительно ниже проводимости водных растворов, что объясняется меньшей степенью диссоциации электролитов в растворителях c малой относительной диэлектрической проницаемостью e (диэлектрическая проницаемость подавляющего большинства растворителей меньше, чем воды (78,3 при 25°С).
Другим фактором, определяющим электрическую проводимость раствора, является вязкость растворителя h (уравнение (224)). Увеличение вязкости растворителя приводит к снижению скорости движения иона и его подвижности. Ионы, имеющие больший радиус в растворе, менее подвижны.
Примеры решения задач
1. Для приготовления 0,800 л раствора в воде растворили 0,759 г гидроксида калия. Сопротивление кондуктометрической ячейки с этим раствором равно 184 Ом. Расстояние между электродами в ячейке ¾ 160 см. Площадь каждого электрода ячейки составляет 0,00200 м2. Рассчитать молярную электрическую проводимость раствора KОН.
Решение:
Рассчитаем удельную электропроводность раствора KОН по уравнению (204), подставляя в него уравнение (202) для константы кондуктометрической ячейки

Рассчитаем концентрацию KОН в растворе
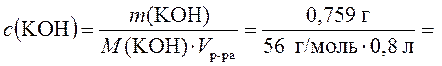

Для расчета молярной электрической проводимости используем уравнение (209)
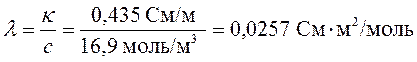 .
.
2. Рассчитать значение рН желудочного сока человека, если молярная электрическая проводимость его при 37оС равна 370 См×см2/моль, а удельное сопротивление – 0,90 Ом×м. Предположить, что в желудочном соке других электролитов, кроме HCl, нет.
Решение:
Рассчитаем по уравнению (205) удельную электропроводность желудочного сока

Рассчитаем концентрацию хлороводородной кислоты в желудочном соке, используя уравнение (209)
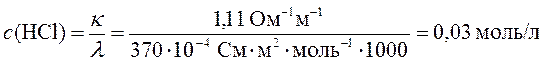
Рассчитаем рН желудочного сока, пренебрегая различием между активностью и концентрацией (полагая коэффициент активности равным 1)
рН = –lg a (H+)» –lg[H+] = –lg[HCl] = –lg0,03 = 1,52
3. Удельная электрическая проводимость насыщенного раствора AgBr равна 11,1×10–6 См/м. Найти константу растворимости соли, если l 0(Ag+) = 61,9×10–4 Cм×м2/моль; l 0(Br–) = 78,4×10–4 Cм×м2/моль; k (H2O) = 2,0×10–6 См/м.
Решение:
Определим удельную электрическую проводимость AgBr:
k (AgBr) =  k р-ра(AgBr) – k (H2O) = (11,1 – 2,0)×10–6 =
k р-ра(AgBr) – k (H2O) = (11,1 – 2,0)×10–6 =
= 9,1×10–6 См/м
l 0(AgBr) = l 0(Ag+) + l 0(Br–) = (61,9 + 78,4)×10–4 =
= 140,3×10–4 См×м2/моль
Насыщенный раствор малорастворимой соли можно с хорошей точностью считать бесконечно разбавленным раствором, тогда:
l (AgBr) = l 0(AgBr),
Растворимость бромида серебра для случая, рассматриваемого в задаче, совпадает с его концентрацией, которую рассчитаем из уравнения (209)


Константа растворимости Ks (AgBr) бромида серебра, диссоциирующего по реакции
AgBr Ag+ + Br–,
равна
Ks (AgBr) = [Ag+]×[Br–]
Концентрация растворенного электролита при условии его полной диссоциации совпадает с концентрациями ионов серебра и брома
S (AgBr) = [Ag+] = [Br–]
Тогда, подставляя значение растворимости в уравнение для константы растворимости, получим
Ks (AgBr) = S 2 = (6,48×10–7)2 = 4,21×10–13 (моль/л)2
4. Молярная электропроводность цианоуксусной кислоты следующим образом зависит от ее концентрации в водном растворе при 298 К:
| с, моль/л×103 | 0,4660 | 1,856 | 7,335 | |
| l, Ом–1×см2/моль | 386,1 | 347,0 | 282,6 | 193,9 |
Рассчитать среднее значение константы диссоциации Ka цианоуксусной кислоты.
Решение:
Воспользуемся уравнением (221)

Подставляя последовательно данные из условия, рассчитаем значения константы и найдем ее среднее значение





5. Рассчитать удельную электрическую проводимость 0,1 М раствора уксусной кислоты при 25оС (Ka (СН3СООН) = 1,75×10–5 моль/л).
Решение:
Рассчитаем, предполагая, что степень диссоциации мала по сравнению с 1, степень диссоциации кислоты по уравнению (222)

Действительно, степень диссоциации составляет приблизительно 1% от 1, следовательно, предположение о малости a справедливо, и уравнение для расчета было выбрано правильно. Рассчитаем предельное значение молярной электропроводности кислоты, используя уравнение (211) Кольрауша
l 0(СН3СООH) = l 0(Н+) + l 0(СН3СОО–) = 349,8 + 40,9 =
= 390,7×10–4 См×м2/моль
Рассчитаем по уравнениям (213) и (209) молярную электропроводность кислоты и удельную электропроводность раствора кислоты, переводя концентрацию из моль/л в моль/м3.
l = 0,0132×390,7×10–4 = 5,15×10–4 См×м2/моль
k = 5,15×10–4×0,1×1000 = 0,05 См/м
|
|
|


