 |
Задачи для самостоятельного решения.
|
|
|
|
1. Определите ионную силу раствора, содержащего 1,62 г Ca(HCO3)2 в 250 г воды.
(Ответ: 0,12 моль/л)
2. Вычислите активность иона алюминия в 0,005 М растворе Al2(SO4)3.
(Ответ: 5,53·10–4 моль/л
3. Вычислите активность сульфата меди и сульфата калия в растворе, содержащем 1,59 г CuSO4 и 0,44 г K2SO4 в 250 г воды.
(Ответ: 5,2·10–3; 3,59·10–3 моль/л).
4. Определите средний коэффициент активности ионов NaOH в растворе, содержащем 1,0 г NaOH в 150 г Н2О.
(Ответ: 0,62).
5. Средний коэффициент активности ионов иодида калия в водном растворе равен 0,872. Рассчитайте ионную силу этого раствора.
(Ответ: 0,0137 моль/л).
Буферные системы и растворы
Основные уравнения
Показатель рН большинства биологических жидкостей организма изменяется незначительно при незначительных внешних воздействиях, так как эти жидкости являются буферными растворами.
v Буферный раствор – это раствор, содержащий протолитическую систему, рН которой изменяется незначительно при добавлении к ней небольших количеств кислоты или щелочи.
Компонентами протолитических буферных систем являются донор протона и акцептор протона, представляющие собой сопряженную кислотно-основную пару. Такими парами могут быть:
1) слабая кислота и соль этой кислоты и сильного основания (CH3COOH + CH3COONa);
2) слабое основание и соль этого основания и сильной кислоты (NH4OH + NH4Cl);
3) смесь солей многоосновных кислот (Na2HPO4 + NaH2PO4).
Механизм действия буферной системы можно объяснить следующим образом. Например, в растворе, содержащем 0,1 М CH3COOH и 0,1 М CH3COONa, в результате полной диссоциации соли:
| CH3COONa ® CH3COO– + Na+, | (191) |
анионы CH3COO– подавляют диссоциацию слабой кислоты
| CH3COOH CH3COO– + H+, | (192) |
Если к раствору, содержащему уксусную кислоту и ацетат натрия, добавить сильную кислоту, то содержащиеся в ней ионы водорода H+ будут реагировать с анионами CH3COO–, образуя недиссоциированные молекулы CH3COOH. При этом изменения рН раствора, содержащего такую буферную систему, будут значительно меньше, чем при добавлении такого же количества сильной кислоты к такому же объему чистой воды.
|
|
|
Если к раствору, содержащему уксусную кислоту и ацетат натрия, добавить сильное основание, то добавляемые ионы гидроксила будут реагировать с ионами водорода, содержащимися в растворе, образуя молекулы воды:
| H+ + OH– H2O. | (193) |
Расходование ионов H+ в реакции (193) приводит к диссоциации молекул CH3COOH в реакции (192) и образованию новых ионов H+. При этом изменения рН раствора, содержащего буферную систему, будут значительно меньше, чем при добавлении такого же количества сильного основания к такому же объему чистой воды.
Уравнение, используемое для расчета рН буферного раствора, содержащего слабую кислоту и соль этой кислоты и сильного основания (уравнение Гендерсона-Хассельбаха), выводится из уравнения для концентрационной константы диссоциации соответствующей кислоты и имеет вид:
 , ,
| (194) |
где с кислоты и с соли – концентрации кислоты и соли в буферном растворе. Эти концентрации можно рассчитать по концентрациям кислоты и соли в исходных растворах и их объемам, которые были взяты для приготовления буферного раствора:
 . .
| (195) |
Уравнение для расчета рН буферного раствора, содержащего слабое основание и соль этого основания и сильной кислоты, выводится аналогично и также называется уравнением Гендерсона – Хассельбаха:
 , ,
| (196) |
или записанное через исходные концентрации и объемы растворов основания и соли:
 , ,
| (197) |
При выводе этого уравнения коэффициенты активности всех ионов, а также молекул кислоты и основания были приняты равными 1.
Уравнения (194), (196) показывают, что рН буферного раствора данного состава определяется отношением концентраций кислоты и соли или основания и соли и поэтому не должен зависеть от разбавления, так как при изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз. На практике рН буферного раствора слабо зависит от разбавления, так как коэффициенты активности ионов зависят от концентрации, а более точные уравнения для расчета рН буферных растворов выводятся из уравнений для термодинамических констант равновесия с учетом коэффициентов активностей ионов.
|
|
|
Величину буферного действия характеризуют с помощью буферной емкости.
v Буферной емкостью раствора (В) называется число моль-эквивалентов сильной кислоты или щелочи, которые нужно добавить к 1 литру буферного раствора, чтобы изменить величину рН на единицу.
Различают буферную емкость по кислоте 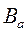 и по основанию
и по основанию  , которые рассчитываются с помощью уравнений:
, которые рассчитываются с помощью уравнений:
 , ,
| (198) |
 , ,
| (199) |
где с экв и V – молярная концентрация эквивалентов и объем добавленной кислоты или щелочи;  – сдвиг водородного показателя буферного раствора, вызванный добавлением сильной кислоты или щелочи; V буф.р-ра – исходный объем буферного раствора.
– сдвиг водородного показателя буферного раствора, вызванный добавлением сильной кислоты или щелочи; V буф.р-ра – исходный объем буферного раствора.
Буферная емкость зависит от концентраций компонентов в буферном растворе и их отношения. Чем выше концентрация компонентов, тем больше буферная емкость. При разбавлении буферного раствора величина буферной емкости уменьшается вследствие снижения концентрации всех компонентов раствора.
Буферные растворы применяют как стандартные для определения рН и для поддержания необходимой кислотности среды. Многие биологические системы являются буферными. Например, кровь животных и человека представляет собой сложную буферную систему с рН в пределах 7,3 – 7,4. Значение рН крови на одном уровне поддерживается белками плазмы, гемоглобином, фосфатами, гидрокарбонатом натрия и угольной кислотой. Система угольная кислота – гидрокарбонат натрия регулирует содержание кислорода и диоксида углерода в крови.
Примеры решения задач
1. Определите рН буферного раствора, содержащего в 1 л 0,4 моль муравьиной кислоты и 1,0 моль формиата натрия, если р Kа (НСООН) = 3,75.
|
|
|
Решение:
Согласно уравнению  :
:

2. Определите соотношение между концентрациями ацетата натрия и уксусной кислоты, необходимое для приготовлении буфера с рН 5,0.  (р Kа (CН3СООН) = 4,76).
(р Kа (CН3СООН) = 4,76).
Решение:
Используя уравнение Гендерсона – Хассельбаха
 ,
,
найдем отношение 




Следовательно, отношение между концентрациями соли и кислоты должно быть равным 1,74.
3. Как изменится рН, если к ацетатному буферному раствору, содержащему 100 мл раствора уксусной кислоты и 100 мл раствора ацетата натрия с концентрацией компонентов по 0,1 моль/л, прибавить 10 мл раствора гидроксида натрия с концентрацией 0,1 моль/л? (р Kа (CН3СООН) = 4,76)
Решение:
До прибавления раствора гидроксида натрия рН ацетатного буферного раствора был равен

После добавления щелочи возрастает количество ацетатных ионов и уменьшается количество молекул кислоты, поэтому уравнение Гендерсона – Хассельбаха принимает следующий вид:
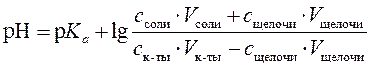

Изменение рН раствора равно

|
|
|


