 |
Задачи для самостоятельного решения.
|
|
|
|
1. Вычислить потенциал медного электрода в растворе, содержащем 0,16 г CuSO4 в 200 см3 воды при 25оС. Расчет провести без учета и с учетом ионной силы раствора.
(Ответ: 0,268 В; 0,253 В).
2. Вычислить потенциал серебряного электрода (относительно стандартного водородного электрода), погруженного в насыщенный раствор роданида серебра, если K s(AgCNS) при 25оС равен 1,16×10–12 (моль/л)2.
(Ответ: 0,426 В).
3. Рассчитайте величину окислительно-восстановительного потенциала редокс-пары Fe3+ | Fe2+ при отношении активностей а (Fe3+)/ а (Fe2+)=10.
(Ответ: 0,830 В)
4. Определите окислительно-восстановительный потенциал редокс-пары BrO3–, H+ | Br–, если с (BrO3–) = с (Br–) = с (H+) = 0,01 моль/л, а стандартный окислительно-восстановительный потенциал этой редокс-пары при комнатной температуре Е° = 0,45 В. Окислительно-восстановительная полуреакция имеет вид:
BrO3–+ 6 H+ + 6 e– = Br– + 3Н2О.
Коэффициенты активности ионов принять равными единице.
(Ответ: 0,33 В)
5. Окислительно-восстановительный потенциал редокс-пары Sn4+ | Sn2+ при комнатной температуре равен 0,200 В. Рассчитайте, чему равно отношение активностей окисленной и восстановленной форм а (Sn4+)/ а (Sn2+) в данном растворе. Стандартный окислительно-восстановительный потенциал указанной редокс-пары при комнатной температуре равен Е° = 0,15 В.
(Ответ: 50).
Гальванические элементы и ЭДС
Основные уравнения
Гальваническим элементом называют электрохимическую цепь, составленную из двух электродов.
Если разность электрических потенциалов на электродах гальванического элемента измеряется в условиях равновесия, то она называется электродвижущей силой гальванического элемента или сокращенно ЭДС. По соглашению ЭДС должна измеряться так, чтобы она была положительной величиной. ЭДС измеряется с помощью милливольтметров или иономеров, которые имеют большое входное сопротивление (более 1012 Ом), при этом измерительный ток так мал (менее 10–12 А), что с хорошей точностью можно считать, что гальванический элемент находится в состоянии равновесия.
|
|
|
ЭДС цепи – это потенциал правого электрода относительно левого
Е = Е правый – Е левый
Так как ЭДС всегда величина положительная, то это означает, что в символической записи цепи справа нужно располагать более положительный электрод, а слева – более отрицательный. В первом приближении знаки электродов можно определять, если пользоваться таблицей стандартных потенциалов (Приложение 17).
Различают цепи без переноса, то есть без границы двух растворов, и цепи с переносом, когда имеется такая граница.
Чаще всего на практике встречаются концентрационные и химические гальванические элементы.
В концентрационных цепях оба электрода идентичны как по физическому состоянию, так и по химической природе участников окислительно-восстановительных процессов. Они отличаются только концентрацией частиц, входящих в уравнения электродных реакций. Источником электрической энергии в таких цепях является разность энергий Гиббса, обусловленная различными активностями одних и тех же химических веществ. Концентрационные цепи можно приготовить из амальгам разных концентраций в одном и том же растворе; из одинаковых электродов первого или второго рода, находящихся в растворах разной концентрации; из одинаковых газовых электродов, работающих при разных давлениях.
Примером концентрационной цепи без переноса является амальгамная цепь
| Zn(Hg) | ZnSO4 | Zn(Hg) | ||
| a 1 | a 2 |
где a 1 и a 2 – активности цинка в амальгамах. ЭДС такой цепи равна:

| (238) |
и в ней при замыкании левого и правого электрода самопроизвольно протекает процесс растворения цинка на левом электроде и его переход в амальгаму в правом электроде
|
|
|
Zn(a 1) ® Zn(a 2)
Направление самопроизвольного процесса должно быть таким, чтобы на правом электроде шел процесс восстановления, а на левом – окисления.
Примером концентрационной цепи с переносом является цепь
| Cu | CuSO4 ¦ CuSO4 | Cu | |||
| a 1 | a 2 |
где a 1 и a 2 – активности сульфата меди в растворах. Эти растворы отделены друг от друга пористой перегородкой (например, пористым стеклянным фильтром), которая препятствует быстрому смешению растворов, но обеспечивает электрический контакт в цепи. Такая перегородка не препятствует диффузии электролитов из одного раствора в другой.
ЭДС такой цепи равна:

| (239) |
и в ней при замыкании левого и правого электрода самопроизвольно протекает процесс растворения цинка на левом электроде и выделение меди на правом
Zn + CuSO4 ® ZnSO4 + Cu
Из-за диффузии электролитов в области контакта двух растворов, которые отличаются концентрацией или составом (и концентрацией) возникает диффузионная разность потенциалов, которая, складываясь с разностью электродных потенциалов, искажает измеряемую ЭДС гальванического элемента.
Механизм возникновения диффузионного потенциала можно объяснить следующим образом. Пусть для определенности слева направо из более концентрированного в более разбавленный раствор через пористую перегородку диффундирует HCl. В первый момент ионы водорода, имеющие большую подвижность, будут двигаться с большей скоростью, чем ионы хлора. Это приведет к частичному разделению электрических зарядов и появлению положительного заряда справа, а отрицательного – слева. Возникшее электрическое поле будет тормозить катионы водорода, которые теперь будут двигаться медленнее, чем вначале, и ускорять анионы хлора. Очень быстро скорости движения ионов при их диффузии станут одинаковыми и далее ионы будут диффундировать совместно – будет диффундировать HCl.
Для уменьшения диффузионной разности потенциалов два раствора соединяют не через пористую перегородку, а с помощью солевого мостика. Например, его можно изготовить, заполнив U-образную трубку гелем агар-агара, приготовленном на концентрированном растворе KCl. Этот электролит выбирают из-за того, что подвижности ионов калия и хлора близки и возникающая вследствие при диффузии хлорида калия разность потенциалов мала. По этой же причине насыщенным раствором KCl заполняют стандартные хлорсеребряные электроды, применяемые при измерении рН и ионометрии.
|
|
|
Если в области контакта двух растворов диффузионная разность потенциалов устранена (на самом деле снижена) с помощью солевого мостика, то это отражается в записи с помощью двойной вертикальной черты
| Cu | CuSO4 || CuSO4 | Cu | |||
| a 1 | a 2 |
В химических цепях источником энергии является свободная энергия химической реакции, протекающей в электрохимической системе.
Примером химической цепи без переноса является цепь
Pt, H2 | HCl | | AgCl, Ag,
в которой электроды погружены в один и тот же раствор.
В химических цепях с переносом электроды погружены в два различных по своему составу раствора, которые отделены друг от друга пористой перегородкой
| Zn | ZnSO4 ¦ CuSO4 | Cu | |||
| a 1 | a 2 |
где a 1 и a 2 – активности сульфата цинка и сульфата меди в растворах. ЭДС такой цепи (элемент Даниэля – Якоби) равна:
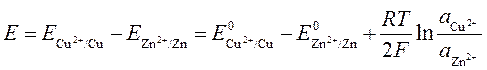
| (240) |
и в ней при замыкании левого и правого электрода самопроизвольно протекает процесс растворения цинка на левом электроде и выделение меди на правом
Zn + CuSO4 ® ZnSO4 + Cu
Среди химических цепей без переноса большое значение имеет цепь
Pt | Cd(Hg) | CdSO4(насыщ.р-р) | Hg2SO4, Hg | Pt
лежащая в основе стандартного элемента Вестона (рис. 54), ЭДС этого гальванического элемента формируется за счет протекания реакции
Cd + Hg2SO4 + 8/3H2O 2Hg(ж) + CdSO4×8/3H2O
и отличается большой стабильностью и малым температурным коэффициентом. Именно поэтому этот гальванический элемент используется в качестве стандарта при потенциометрических измерениях.

|
| Рис. 54. Элемент Вестона |
ЭДС элемента Вестона, выраженная в вольтах в зависимости от температуры, выраженной в шкале Цельсия, равна
E = 1,0183 – 4×10–5(t – 20)
ЭДС гальванического элемента связана с D G протекающей в элементе реакции:

| (241) |
или для стандартных значений:

| (242) |
Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
|
|
|

| (243) |
Если известна зависимость ЭДС элемента от температуры, то изменение энтропии в реакции, протекающей в элементе, можно рассчитать по величине производной  :
:

| (244) |
Зная изменение энергии Гиббса и энтропии в реакции можно рассчитать изменение энтальпии:

| (245) |
Примеры решения задач
1. D Н реакции Pb + Hg2Cl2 = PbCl2 + 2Hg, протекающей в гальваническом элементе, равно –94,2 кДж/моль при 298,2 К. ЭДС этого элемента возрастает на 1,45×10–4 В при повышении температуры на 1 К. Рассчитать ЭДС элемента и D S при 298,2 К.
Решение:

D G = D H – T D S = – nFE, откуда

2. Определить D Н, D G и D S реакции Pb + 2AgCl 2Ag + PbCl2, протекающей в гальваническом элементе при 25оС по следующим данным:
| t,oC | Е, В |
| 0,49037 | |
| 0,48963 |
Решение:
Находим температурный коэффициент ЭДС


Рассчитываем ЭДС при 25оС

Рассчитываем изменение свободной энергии и энтропии:
D G = – nFE = –2×96500×0,49 = –9,46×104 Дж
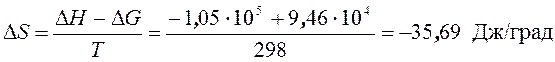
3. Зависимость ЭДС от температуры элемента, в котором протекает реакция Zn + Hg2SO4 = ZnSO4 + 2Hg выражается уравнением: Е = 1,4328 – 0,00119(Т – 288) – 0,057×10–4(Т – 288)2. Рассчитать D G, D S, D H при 303 К.
Решение:
D G = – nFE
Е = 1,4328 – 0,00119(303 – 288) – 0,057×10–4(303– 288)2 = 1,4137 В
D G = –2×96500×1,4137 = –272,8 кДж

D G = D H – T D S,
D H = D G + T D S = –272,8 кДж + 303 К × 262,673×10–3 кДж/К =
= –151,7 кДж
4. Рассчитать максимальную работу и изменение энтальпии для гальванического элемента Вестона, если известна ЭДС этого элемента при 2-х температурах:
| Т, К | ||
| Е, В | 1,01830 | 1,01807 |
Решение:
В гальваническом элементе Вестона протекает химическая реакция:
Cd + Hg2SO4 + 8/3H2O 2Hg(ж) + CdSO4×8/3H2O
Число электронов, участвующих в реакции,
n = 2, Amax = –D G
D G = – nFE = –2×9,65×107×1,0183 = –1,963×108 Дж/кмоль;
Amax = 1,963×108 Дж/кмоль;

Принимая
 ,
,
D H = –2×9,65×107×[293×(–4,6×105) – 1,0183] = –1,991×108 Дж/кмоль
|
|
|


