 |
Задачи для самостоятельного решения. CH3COOCH3 + NaOH ® CH3COONa + CH3OH
|
|
|
|
1. Реакция омыления метилацетата гидроксидом натрия при 298 К протекает по уравнению
CH3COOCH3 + NaOH ® CH3COONa + CH3OH
Для этой реакции при 298 К получена зависимость концентрации гидроксида натрия от времени
| № | t, мин | c NaOH, моль/л |
| 0,01000 | ||
| 3,00 | 0,00740 | |
| 5,00 | 0,00634 | |
| 7,00 | 0,00550 | |
| 10,0 | 0,00464 | |
| 15,0 | 0,00363 | |
| 25,0 | 0,00254 |
Рассчитать, пользуясь таблицей, зависимость средней скорости этой химической реакции от времени.
2. Построить, пользуясь таблицей, приведенной в предыдущей задаче, график зависимости концентрации гидроксида натрия от времени. Рассчитать графическим методом зависимость скорости этой химической реакции от времени и построить соответствующий график.
Формальная кинетика необратимых реакций нулевого, первого, второго порядков
Основные уравнения
Основной постулат химической кинетики – закон действия масс для кинетики
Скорость реакции зависит от природы реагирующих веществ, температуры, наличия катализатора, концентрации и других факторов.
Согласно основному постулату химической кинетики – закону действующих масс для кинетики, скорость химической реакции
n AА + n BB ® n CC + n DD
определяется выражением
 , ,
| (255) |
где k – константа скорости реакции; c A и c B – концентрации реагирующих веществ; n A и n B – порядки реакции по веществам А и В.
Константа скорости химической реакции есть скорость реакции при концентрациях реагирующих веществ, равных единице. В этом случае предыдущее уравнение упрощается
 . .
| (256) |
Константа скорости, как и скорость, зависит от природы реагирующих веществ, температуры, наличия катализатора, но не зависит от концентрации.
Показатель степени, в которой концентрация вещества входит в уравнение закона действия масс для кинетики, называется порядком реакции по данному веществу. Сумма порядков по всем веществам называется общим порядком реакции.
|
|
|
Если реакция является элементарной реакцией (протекает в одну стадию), то порядки по веществам ni совпадают со стехиометрическими коэффициентами vi при этих веществах в уравнении реакции.
Молекулярность химической реакции
Понятие молекулярность химической реакции относится только к элементарной стадии (акту) реакции и определяется числом молекул (частиц), участвующих в элементарном акте реакции.
По молекулярности различают мономолекулярные, бимолекулярные и тримолекулярные элементарные стадии реакций.
К мономолекулярным стадиям реакций типа А ® В или А ® В + С + … относятся процессы термического разложения молекул на более простые частицы, цис-транс- изомеризации, раскрытия циклов, рацемизации. Например, раскрытие цикла

Бимолекулярными называются стадии реакции типа А + В ® С или 2А ® В. Примерами таких реакций являются реакции, протекающие в газовой фазе
H + H2 ® H2 + H
CO + O2 ® CO2 + O
K + HBr ® KBr + H
а также в растворах
2CH3COOH ® (CH3COOH)2
Fe+3 + Fe+2 ® Fe+2 + Fe+3
Тримолекулярные реакции А + 2В ® С или 3А ® В встречаются редко, так как одновременная встреча трех частиц в элементарном акте химического превращения маловероятна. Примерами таких реакций в газовой фазе являются реакции с участием оксида азота (II)
2NO + O2 ® 2NO2
2NO + 2H2 ® 2H2O + N2
2NO + Cl2 ® 2NOCl
Четырехмолекулярные элементарные стадии реакций в действительности не встречаются, так как одновременная встреча четырех частиц – событие очень маловероятное; в этом случае преобладают процессы, сопровождающиеся двойными и тройными столкновениями.
Если реакция является элементарной, то для нее понятия "порядок" и "молекулярность" совпадают.
Реакция нулевого порядка
|
|
|
Кинетическое уравнение для реакции нулевого порядка в дифференциальной форме имеет вид
 , ,
| (257) |
в интегральной:
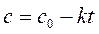 . .
| (258) |
где k – константа скорости реакции нулевого порядка, моль/(л×с); c 0 – концентрация исходного вещества в начальный момент времени (t = 0), моль/л; с – текущая концентрация исходного вещества в момент времени t, моль/л; t – время, прошедшее от момента начала реакции, с.
Это уравнение линейно относительно переменных с и t. В другой форме это уравнение имеет вид:
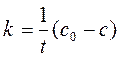 . .
| (259) |
В этой форме его удобно применять для расчета константы скорости, если известна концентрация c реагента в момент времени t.
Время полуреакции(период полупревращения) t 1/2 – время за которое концентрация исходного вещества уменьшается в 2 раза – равно:
 . .
| (260) |
Период полупревращениядля реакции нулевого порядка прямо пропорционален начальной концентрации реагента. Чем больше начальная концентрация, тем за больше время израсходуется ее половина.
Реакция первого порядка
Кинетическое уравнение для реакции первого порядка в дифференциальной форме имеет вид:
 , ,
| (261) |
в интегральной:
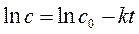
| (262) |
или
 , ,
| (263) |
где k – константа скорости реакции первого порядка, 1/с; c 0 – концентрация исходного вещества в начальный момент времени (t = 0), моль/л; с – текущая концентрация исходного вещества в момент времени t, моль/л; t – время, прошедшее от момента начала реакции, с.
Это уравнение линейно относительно переменных ln с и t. В другой форме это уравнение имеет вид:
 . .
| (264) |
В этой форме его удобно применять для расчета константы скорости, если известна концентрация c реагента в момент времени t.
Время полуреакции t 1/2 для реакции первого порядка равно:
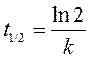 . .
| (265) |
Период полупревращения для реакции первого порядка не зависит от начальной концентрации реагента.
Реакция второго порядка
Кинетическое уравнение для реакции второго порядка, с простейшей кинетической схемой, когда в реакции участвует только один реагент
2А ®
в дифференциальной форме имеет вид:
 , ,
| (266) |
в интегральной:
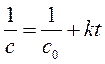 , ,
| (267) |
где k – константа скорости реакции второго порядка, л/(моль×с); c 0 – концентрация исходного вещества в начальный момент времени (t = 0), моль/л; с – текущая концентрация исходного вещества в момент времени t, моль/л; t – время, прошедшее от момента начала реакции, с.
|
|
|
Это уравнение линейно относительно переменных 1/ с и t. В другой форме это уравнение имеет вид:
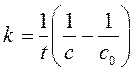 . .
| (268) |
В этой форме его удобно применять для расчета константы скорости, если известна концентрация c реагента в момент времени t.
Время полуреакции t 1/2 для реакции второго порядка равно:
 . .
| (269) |
Период полупревращения для реакции второго порядка обратно пропорционален начальной концентрации реагента. Чем больше начальная концентрация, тем за меньше время израсходуется ее половина.
Примеры решения задач
1. Реакция взаимодействия оксида азота с кислородом
2NO(г) + O2(г) ® 2NO2(г)
является реакцией 3-го порядка. Как изменится скорость этой реакции, если концентрацию оксида азота (II) увеличить в 2,00 раза, а концентрацию кислорода – в 3,00 раза?
Решение:
Для решения воспользуемся уравнением (255)
 ,
,
 .
.
Для упрощения вида уравнения введем обозначения
 и
и  ,
,
тогда до увеличения концентраций скорость равна
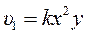 ,
,
а после увеличения
 .
.
После изменения концентраций скорость увеличилась в

по сравнению с исходной.
2. Реакция второго порядка
(СH3CO)2O + H2O ® 2СH3COOH
при большом избытке воды подчиняется кинетике первого порядка по уксусному ангидриду. Константа скорости этой реакции при 15°C равна 0,0454 мин–1. Исходная концентрация уксусного ангидрида равна 0,100 М. Чему будет равна скорость реакции в тот момент, когда концентрация уксусной кислоты станет равной 0,0200 моль/л?
Решение:
Так как исходный раствор является разбавленным, то концентрация воды в нем мало отличается от концентрации воды в чистой воде

и остается практически постоянной в процессе протекания реакции.
Для расчета скорости реакции воспользуемся уравнением (255):
 ,
,  .
.
Так как концентрация воды постоянна, то, ее можно включить в константу скорости:
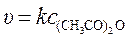 .
.
Из стехиометрических коэффициентов химической реакции гидролиза уксусного ангидрида следует, что если концентрация уксусной кислоты стала равной 0,0200 моль/л, то уксусного ангидрида разложилось в два раза меньше, то есть 0,0100 моль/л, тогда концентрация оставшегося уксусного ангидрида равна
|
|
|

Подставляя ее и значение константы скорости в последнее уравнение, получим
 .
.
3. Превращение перекиси бензоила в этиловый эфир бензойной кислоты (реакция первого порядка) при 333 К прошло за 10,0 мин на 75,0%. Вычислить константу скорости этой реакции и период полураспада.
Решение:
Для расчета применим уравнения (264) и (265):
 ,
, 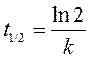 .
.
Так как реакция прошла на 75,0%, то перекиси бензоила осталось 100% – 75,0% = 25,0%, то есть ее концентрация уменьшилась от исходной c 0 до 0,25 c 0. Рассчитаем константу скорости k и время полупревращения t 1/2
 ,
,
 .
.
4. Скорость реакции второго порядка A + B ® … (порядки реакции по веществу А и В равны единице) равна 4,5×10–7 моль/(л×с) при концентрации одного реагента 1,5×10–2 и другого 2,5×10–1 моль/л. Рассчитайте константу скорости в мл/(моль×с).
Решение:
Для решения применим уравнение (255):
 ,
,  ,
,  ,
,
 .
.
5. Разложение N2O5 является реакцией первого порядка. Константа скорости этой реакции при некоторой температуре равна 0,00200 мин–1. Рассчитать сколько процентов N2O5 разложится за 2,00 ч.
Решение:
Для расчета концентрации N2O5 через 2 ч после начала реакции (с) применим уравнение (264)
 ,
,  ,
,
 .
.
Концентрация разложившегося N2O5 равна:
с разлож = с 0 – с = с 0 – 0,7866 с 0 = 0,2134 с 0.
Разложилось N2O5 в процентах:
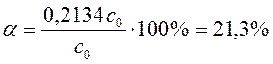 .
.
6. Реакция разложения пероксида водорода в присутствии катализатора в водном растворе протекает как реакция первого порядка. Период полупревращения Н2О2 в данных условиях равен 15,86 мин. Определить время разложения 99,0% Н2О2.
Решение:
Для решения воспользуемся уравнениями (265) и (264):
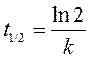

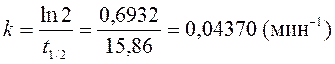 ,
,
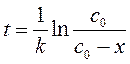 ;
;
где x – концентрация разложившегося пероксида водорода,
x = c 0 – c; c = c 0 – x; с = c 0 – 0,99 c 0 = 0,01 c 0.
 .
.
7. Константа скорости омыления этилового эфира уксусной кислоты едким натром
CH3COOC2H5 + NaOH ® CH3COONa + C2H5OH
при 10°С равна 2,38 л/(моль×мин). Определить время омыления 90,0% этого эфира при смешении 1,00 л 0,0500 М раствора эфира с 1,00 л 0,0500 М NaOH (реакция второго порядка).
Решение:
Так как это реакция второго порядка и исходные концентрации реагентов равны, то применим уравнение (268) для реакции второго порядка
2А ® …
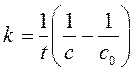
Так как общий объем смеси 2,00 л – в два раза больше, чем исходный объем раствора каждого реагента, то концентрация реагентов из-за разбавления уменьшится в 2,00 раза
с 0 = 0,05/2 = 0,025 (М),
с = с 0 – 0,9 с 0 = 0,1 с 0 = 0,1×0,025 = 0,0025 (М),
 .
.
|
|
|


