 |
Задачи для самостоятельного решения.
|
|
|
|
1. Как изменится скорость прямой реакции
2NO + Cl2 ® 2NOCl
при уменьшении концентрации NО в 4,00 раза, и увеличении концентрации Cl2 в 2,00 раза?
(Ответ: уменьшится в 8 раз)
2. В реакторе, объем которого равен 2,00 л в газовой фазе, содержащей 1,00 моль NO и 2,00 моль H2, протекает реакция по уравнению
2NO + 2H2 ® 2H2O + N2
Во сколько раз уменьшится скорость прямой реакции после того, как прореагирует 0,600 моль NO?
(Ответ: уменьшится в 12,75 раза)
3. Реакция между веществами А и В протекает по уравнению
А + 2В ® С
Концентрация А равна 1,50 моль/л, а В – 3,00 моль/л. Константа скорости реакции равна 0,400 л2/(моль2×с). Найти скорость этой реакции в начальный момент времени и в момент, когда прореагирует 75,0% вещества А.
(Ответ: 5,4 моль/(л×с); 0,084 моль/(л×с))
4. Превращение органического вещества (реакция первого порядка) при 60°С прошло за 10,0 мин на 75,2%. Вычислить константу скорости реакции.
(Ответ: 0,139 мин–1)
5. Раствор этилацетата при концентрации 0,0100 моль/л и температуре 293 K омыляется 0,0100 М раствором NaOH в течение 23,0 мин. на 10,0% (реакция 2-го порядка). Как изменится это время, если уменьшить концентрацию реагирующих веществ в 10,0 раз?
(Ответ: увеличится в 10 раз)
6. Бимолекулярная реакция А + В ® …, для которой начальные концентрации А и В равны, протекает за 10,0 мин на 25,0%. Сколько времени потребуется для того, чтобы реакция прошла на 50,0% при той же температуре?
(Ответ: 30 мин)
Методы определения порядков и констант скоростей реакций
Основные уравнения
Для определения порядка реакций используют две группы методов: интегральные методы и дифференциальные методы.
Интегральные методы
Метод подстановки
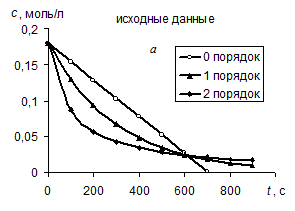
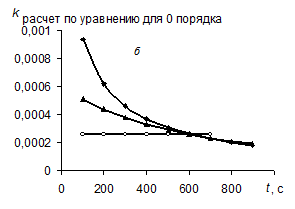
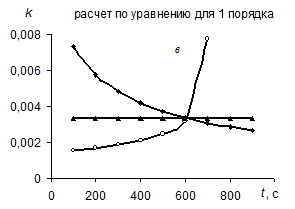
Метод подстановки заключается в экспериментальном определении концентрации исходного вещества в различные моменты времени от начала реакции (рис. а). Затем эти данные используются для расчета значений констант скорости по уравнениям нулевого (259) (рис. б), первого (264) (рис. в) и второго (268) (рис. г) порядков.
|
|
|
| 
|
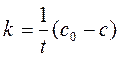
| |
| 
|

| 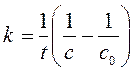
|
Так на рисунке а приведены примеры зависимостей концентрации реагентов, вступающих в реакции 0-го, 1-го и 2-го порядков. В этих трех случаях начальные концентрации реагентов взяты одними и теми же (0,18 моль/л), а константы скорости реакций различны.
Анализируя полученные зависимости, выясняют, по какому уравнению расчет константы скорости дает практически постоянную величину константы с небольшими случайными отклонениями разных знаков. Этому порядку и подчиняется исследуемая реакция.
Так, например, на рисунке б (расчет проводился по уравнению (259) для кинетики реакции 0-го порядка) постоянна величина константы только для реакции такого же – 0-го порядка, а константы реакций других порядков непостоянны. Таким образом, рис. б позволяет распознать реакцию 0-го порядка. Аналогично рис. в позволяет распознать реакцию 1-го порядка, а рис. г – реакцию 2-го порядка.
Значение константы скорости находят или из графика или усреднением значений в таблице.
Графический метод
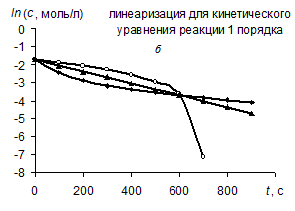
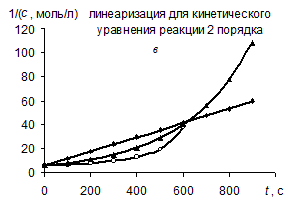
В соответствии с графическим методом, измерив концентрации исходного вещества в различные моменты времени от начала реакции, строят графики зависимостей " с – t ", "ln с – t ", "1/ с – t ", в которых линеаризуются кинетические уравнения (258), (262) и (267) реакций 0-го, 1-го и 2-го порядков соответственно. Если на одном из этих графиков зависимость для изучаемой реакции является прямолинейной, то это означает, что порядок изучаемой реакции совпадает с тем, для которого выведено соответствующее уравнение (258), (262) или (267).
| Так, например, в координатах рисунка а линейна именно зависимость для реакции 0-го порядка, в координатах рисунка б – зависимость для реакции 1-го порядка, в координатах рисунка в – зависимость для реакции 2-го порядка. | 
|
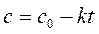
| |
| 
|
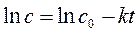
| 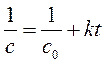
|
Значение константы скорости реакции равно угловому коэффициенту прямой.
|
|
|
|
|
|


