 |
Рибофлавин входит в состав ФМН
|
|
|
|
Дыхательные цепи микроорганизмов состоят из следующих важнейших, локализованных в мембране, переносчиков атомов водорода или электронов: флавопротеинов, железосерных белков, хинонов и цитохромов.
Флавопротеины – коферменты, в состав которых входит витамин В2, а в качестве простетических групп в них выступают флавинмононуклеотид (ФМН) или флавинадениндинуклеотид (ФАД).
Флавопротеины осуществляют перенос атомов водорода, т. е. являются дегидрогеназами. Дегидрогеназа, которая содержит в качестве простетической группы ФМН, является НАДФ · Н2-дегидрогеназой. Это стартовый переносчик в дыхательной цепи, осуществляющий перенос водорода с НАДФ · Н2 на следующие компоненты дыхательной цепи. Дегидрогеназа катализирует окисление янтарной кислоты в фумаровую в ЦТК. Атомы водорода от ФАД · Н2 поступают сразу на хиноны, локализованные на последних этапах электронтранспортной цепи.
Железосерные белки (FeS-белки) содержат железосероцентры, в которых атомы железа связаны, с одной стороны, с серой аминокислоты цистеина, а с другой – с неорганической сульфидной серой (рис. 4). Дыхательные цепи содержат большое число FeS-центров. Железосероцентры, в зависимости от строения, могут осуществлять одновременный перенос одного или двух электронов, что связано с изменением валентности атомов железа.
Хиноны – жирорастворимые соединения. Хиноны липофильны и поэтому локализуются в липидной фазе мембраны. Они переносят атомы водорода. Они служат «сборщиками» водорода, поставляемого различными коферментами и простетическими группами в дыхательной цепи, и передают его цитохромам. Таким образом, они функционируют в дыхательной цепи на участке между флавопротеинами и цитохромами.
|
|
|
Цитохромы принимают участие на заключительном этапе в цепи переноса электронов. К ним электроны поступают от хинонов. В качестве простетической группы цитохромы содержат гем. Цитохромы окрашены; они отличаются друг от друга спектрами поглощения и окислительно-восстановительными потенциалами. Различают цитохромы а, а3, b, c, o и ряд других. Конечные цитохромы дыхательной цепи – это цитохромы а + а3 или цитохромоксидаза. Они передают электроны на молекулярный кислород, т. е. катализируют восстановление молекулярного кислорода до воды. В реакционном центре цитохромоксидазы, помимо двух гемов, содержатся два атома меди.
Дыхательная цепь имеет следующие особенности:
1) Одни ее компоненты переносят только атомы водорода, а другие – только электроны.
2)Переносчики атомов водорода и переносчики электронов последовательно чередуются в дыхательной цепи. Флавопротеины и хиноны осуществляют перенос атомов водорода, а FeS-белки и цитохромы – электронов.
3) В составе дыхательных цепей у микроорганизмов выявлены определенные различия.
5. активаторы и ингибиторы ферментов, привести примеры активатора и ингибитора амилазы слюны
Активаторами называют вещества, которые повышают активность ферментов. Примером таких соединений являются аминокислота цистин и восстановленный глютатион, содержащие свободную –SH-группу. Их активирующее действие заключается в том, что они восстанавливают дисульфидные связи с образованием –SH-групп, необходимых для проявления каталитической активности тиоловых ферментов. Кроме того, некоторые ферменты активируются металлами, которые либо участвуют в построении активного центра, либо стабилизируют пространственную конформацию ферментного белка и тем самым обеспечивают проявление каталитических функций.
Активность фермента α -амилазы слюны человека повышается в присутствии анионов Clˉ и катионы кальция.
|
|
|
Ингибиторы замедляют скорость биохимических реакций, а в ряде случаев полностью приостанавливают её. Процесс ингибирования может быть обратимым и необратимым.
При необратимом ингибировании ингибитор ковалентно связывается с ферментом, необратимо изменяя его конформацию. После удаления ингибитора активность фермента не восстанавливается.
Необратимыми ингибиторами также являются цианиды, подавляющие активность ферментов цитохромов, содержащих железо; этилендиаминтетраацетат (ЭДТА), подавляющий действие α -амилазы, за счёт связывания с ионами Ca+2 (кофактора α -амилазы).
При обратимом ингибировании активность фермента восстанавливается после удаления ингибитора. Обратимые ингибиторы бывают конкурентного, неконкурентного, бесконкурентного и смешанного действия.
Первая группа – это близкие аналоги субстратов, содержащие весь набор или, по крайней мере, большую часть групп, узнаваемых активным центром фермента, и поэтому образующие комплекс фермент-ингибитор, сходный с комплексом фермент-субстрат. Однако в силу специфики своей структуры они не подвергаются ферментативному превращению. Занимая активный центр, эти ингибиторы препятствуют связыванию субстрата и тем самым протеканию ферментативной реакции. Они фактически конкурируют с субстратом за взаимодействие с активным центром и поэтому их называют конкурентными ингибиторами. Конкурентное ингибирование может быть снято при увеличении концентрации субстрата.
Неконкурентное ингибирование отличается от конкурентного тем, что оно не может быть снято увеличением концентрации субстрата. Неконкурентный ингибитор подавляет каталитическое превращение субстрата в продукты реакции. Полагают, что при неконкурентном ингибировании ингибитор связывается с функционально важной группой фермента, не препятствуя связыванию субстрата, при этом деформируется активный центр, что приводит к нарушению комплементарности к субстрату и снижению активности фермента.
Бесконкурентное ингибирование наблюдается в том случае, когда ингибитор связывается с фермент-субстратным комплексом, переводя его в неактивную форму.
|
|
|
При смешанном ингибировании ингибитор действует как на участок связывания, так и на каталитический центр фермента.
билет № 7
1. Зависимость активации ферментов от среды. рН среды а-амилазы.
Ферменты, как и любые белки, чувствительны к значению pH среды. От концентрации водородных ионов (Н+) зависит ионизация функциональных групп в молекуле белка фермента.
Во-первых, водородные ионы воздействуют на активный центр фермента. При различных значениях pH в реакционной среде активный центр может быть слабее или сильнее ионизирован, больше или меньше экранирован соседними с ним группами.
Во-вторых, концентрация водородных ионов влияет на состояние белковой части фермента, определяя соотношение в нем анионных и катионных групп, что сказывается на третичной структуре. Как известно, именно при формировании третичной структуры фермента образуются активные центры фермента.
В-третьих, pH среды влияет на степень ионизации субстрата, фермент- субстратного комплекса и продуктов реакции.
Для каждого фермента существует свое оптимальное значение pH среды (рН0ПТ), при котором его активность максимальна. Например, амилаза наиболее активна при pH 6, 8—7, 0.
2. четвертая структура ферментов. Тип катализирующей реакции.
В соответствии с международной Классификацией ферментов, по типу катализируемой реакции все ферменты подразделяются на 6 классов.
К 4му относятся Лиазы, обеспечивающие расщепление связи углерода с кислородом, азотом, серой или другим углеродом без участия воды. Обратимые реакции образования и разрыва двойных связей, сопровождающиеся отщеплением или присоединением групп атомов по её месту, а также образованием циклических структур.
3. Какова связь между ферментами и витаминами? Напишите формулу ФМН и укажите, какой витамин входит в её состав.
Витамины-это катализаторы все обменных процессов, входящие в состав ферментативных систем. В эти системы входят все водорастворимые витамины, а жирорастворимые входят только частично. Главной и удивительной особенностью витаминов является их способность преобразования в коферменты, прикрепляющиеся к ферменту и способные усиливать их воздействие. Ферментативная система в свою очередь – это совокупность ферментных комплексов, которые регулируют обменные процессы, ускоряют химические реакции, расщепляют одни вещества и образуют другие.
|
|
|
Коферменты настолько эффективные вещества, что для того, чтобы они стали катализаторами определенного процесса, их требуется ничтожно малое количество. Отсюда и вывод, что витаминов для организма человека нужно немного.
Фермент с присоединенным коферментом является участником синтеза сложных белков и процесса энергетического обмена веществ.

Рибофлавин входит в состав ФМН
4. Цитохромы в ОВР.
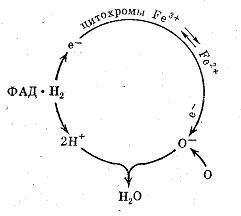
Цитохромная система. Среди оксидаз очень важную роль играют железосодержащие ферменты и переносчики, относящиеся к цитохромной системе. В нее входят цитохромы и цитохромоксидаза. Включаясь в определенной последовательности в процесс переноса электронов, они передают их от флавопротеинов на молекулярный кислород. Все компоненты цитохромной системы содержат железопорфириновую простетическую группу.
При переносе электронов цитохромами железо обратимо окисляется и восстанавливается, отдавая или приобретая электрон и изменяя таким образом свою валентность. В дыхательной цепи направление транспорта электронов определяется величиной окислительно-восстановительного потенциала цитохромов.
В этой системе передавать электроны непосредственно на кислород способна только цитохромоксидаза (цит. а + а3). Из всех известных оксидаз она имеет наибольшее сродство к кислороду. Ингибиторами цитохромоксидазы являются СО, цианид, азид.
Цитохромы с, b, a.
В отличии от гема гемоглобина атом железа в цитохромах может обратимо переходить из двух в трехвалентное состояние это обеспечивает транспорт электронов.
Цитохромной системе принадлежит основная роль в передаче водорода от анаэробных и флавиновых дегидрогеназ молекулярному кислороду воздуха. В состав цитохромной системы входят убихиноны (жирорастворимые хиноны) и четыре цитохрома, представляющие собой протеиды, простетическая группа которых содержит железо. Железо цитохромов легко принимает и отдает электроны, т. е. легко переходит из окисной формы в закисную и обратно. Суть окислительно-восстановительных реакций, осуществляемых цитохромами, заключается в том, что один из них отнимает электрон от атома водорода, удерживаемого восстановленными формами анаэробных или флавиновых дегидрогеназ, и передает его другим цитохромам. Последний в цепочке цитохромов—фермент цитохромоксидаза. Он передает электрон кислороду воздуха и тем самым активирует его. Такой активированный кислород вступает в реакцию с ионизированным атомом водорода, образуя воду или перекись водорода. Таким образом, цитохромы не участвуют в переносе атомов водорода, а передают только электроны, меняя при этом свою валентность.
|
|
|
Роль цитохромов в окислительных процессах иллюстрируется следующей схемой:
5. Каков принцип качественного определения активности ферментов?
Рекомендовано измерять активность фермента при температуре 25°С, оптимуме рН и концентрации субстрата, превышающей концентрацию насыщения. В этих случаях скорость соответствует нулевому порядку реакции в отношении субстрата и будет зависеть только от концентрации фермента.
Для выражения активности в практической работе с ферментами часто пользуются произвольными понятиями удельной и молярной активности. Удельную активность фермента принято выражать числом единиц ферментативной активности на 1 мг белка (или числом каталов на 1 кг активного белка). Количество молекул субстрата, подвергающихся превращению одной молекулой фермента в продукт в процессереакции в единицу времени при полном насыщении фермента субстратом, принято называть числом оборотов фермента, или молярнойактивностью (молярная каталитическая активность выражается в каталах на 1 г-моль фермента). Одна молекула каталазы эритроцитовспособна, например, расщепить в 1 с 44000 молекул перекиси водорода.
|
|
|


