 |
4) схема комплексов тканевого дыхания
|
|
|
|
8 билет
1. Зависимость активности ферментов от температуры. Примеры.
Зависимость активности ферментов (скорости реакции) от температуры описывается колоколообразной кривой с максимумом скорости при значениях оптимальной температуры для данного фермента. Повышение скорости реакции при приближении к оптимальной температуре объясняется увеличением кинетической энергии реагирующих молекул.
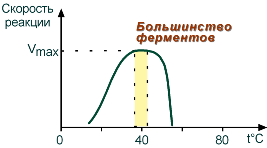
Зависимость скорости реакции от температуры
Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т. е. до температур денатурации белков. При понижении температуры активность ферментов понижается, но не исчезает совсем.
2. 5 класс ферментов. Какие реакции катализирует.
В соответствии с международной Классификацией ферментов, по типу катализируемой реакции все ферменты подразделяются на 6 классов.
К 5му классу относятся Изомеразы, проводящие реакции внутримолекулярного переноса (рацемазы мутазы, внутримолекулярные оксидоредуктазы). Могут катализировать внутримолекулярные ОВР, осуществляя взаимные превращения альдоз и кетоз, кетонных и енольных групп, перемещения двойных связей внутри молекулы. Являются сложными ферментами. К их коферментам относятся пиридоксалевые, дезоксиаденозинкобаламин, пептидныегруппы, фосфаты моносахаридов.
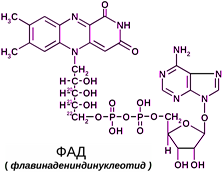
3. Связь между ферментами и витаминами. Какой витамин входит в ФАД, формула фад.
Витамины-это катализаторы все обменных процессов, входящие в состав ферментативных систем. В эти системы входят все водорастворимые витамины, а жирорастворимые входят только частично. Главной и удивительной особенностью витаминов является их способность преобразования в коферменты, прикрепляющиеся к ферменту и способные усиливать их воздействие. Ферментативная система в свою очередь – это совокупность ферментных комплексов, которые регулируют обменные процессы, ускоряют химические реакции, расщепляют одни вещества и образуют другие.
|
|
|
Коферменты настолько эффективные вещества, что для того, чтобы они стали катализаторами определенного процесса, их требуется ничтожно малое количество. Отсюда и вывод, что витаминов для организма человека нужно немного.
Фермент с присоединенным коферментом является участником синтеза сложных белков и процесса энергетического обмена веществ.
В ФАД( Флавинадениндинуклеотид ) входит витамин В2 – рибофлавин
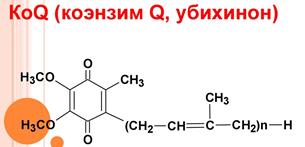
4. Убихинон. Функции и строение.
Убихинон, подобно НАД и ФАД, может играть роль промежуточного переносчика водородных атомов, т. е. электронов и протонов.
Считают, что восстановленная форма флавиновых ферментов в цепи дыхательных катализаторов передает атомы водорода (протоны и электроны) КоQ. Как всякий хинон, КоQ может существовать в окисленной и восстановленной форме, что и обеспечивает его функционирование в дыхательной цепи.
1)перенос электронов через мембрану митохондрий(самая основная функция)
2)участвует в овр организма в качестве кофермента, а также играет важную роль в процессах энергообразования в организме
3)нормализует уровень холестерина, влияет на липидный обмен
4)поддерживает работу скелетной мускулатуры, участвует в процессах сокращения сердечной мышцы
5)способствует образованию эритроцитов; необходим для развития эмбриона
5. Какие принципы определения активности ферментов.
1)Регуляция количества фермента путем изменения его количества, т. е. путем регуляции скорости его синтеза и распада.
2)Регуляция каталитической активности ферментов: Изменением каталитической активности фермента называют все изменения его активности, происходящие при постоянном количестве ферментного белка.
|
|
|
3) Третий принцип регуляции активности ферментов заключается в пространственной организации клеточных компонентов.
• Скорость реакций можно повысить, если собрать различные ферменты, участвующие в метаболической цепи, в одно место.
• Это достигается двумя способами:
• Первый способ - образование большого мультиферментного комплекса. Тогда ферменты работают как конвейер.
• Второй способ увеличения концентрации ферментов в одном месте с помощью компартментализации (от слова " компартмент" - " купе" ).
4) Четвертый принцип регуляции активности ферментов основан на участии в реакции наряду с ферментами активаторов или ингибиторов ферментативной реакции
9 билет
1) зависимость активности фермента от его конц-ии и конц-ии субстрата
При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента и скорость реакции снижается.
Зависимость от концентрации фермента
При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т. к. большее количество молекул фермента производит большее число молекул продукта.

2) изоферменты, примеры
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры).
Как правило, изоферменты имеют четвертичную структуру, т. е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг).
|
|
|
Определение активности разных изоферментов КК в сыворотке крови имеет клинико-диагностическое значение.
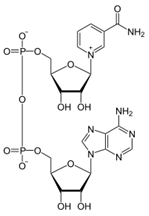
3) формула над, витамин в над, связь между витаминами и ферментами
Витамины-это катализаторы все обменных процессов, входящие в состав ферментативных систем. В эти системы входят все водорастворимые витамины, а жирорастворимые входят только частично. Главной и удивительной особенностью витаминов является их способность преобразования в коферменты, прикрепляющиеся к ферменту и способные усиливать их воздействие. Ферментативная система в свою очередь – это совокупность ферментных комплексов, которые регулируют обменные процессы, ускоряют химические реакции, расщепляют одни вещества и образуют другие.
Коферменты настолько эффективные вещества, что для того, чтобы они стали катализаторами определенного процесса, их требуется ничтожно малое количество. Отсюда и вывод, что витаминов для организма человека нужно немного.
Фермент с присоединенным коферментом является участником синтеза сложных белков и процесса энергетического обмена веществ.
НАД - никотинамидадениндинуклеотид
4) схема комплексов тканевого дыхания
|
|
|


