 |
1.4.2. Геометрическая интерпретация условия фазового равновесия
|
|
|
|
Основное термодинамическое условие фазового равновесия при р и Т -const (например, между твердой ( S ) и жидкой ( L ) фазами двойной системы) – это равенство химических потенциалов компонентов в каждой фазе, т. е. μ AS = μ AL и μ ВS =μ В L .
Геометрической интерпретацией условия фазового равновесия (при р и Т -const) является проведение общей касательной к концентрационным зависимостям свободной энергии Гиббса, построенным для каждой фазы. Точки касания соответствуют составу равновесных фаз.
Поясним данное утверждение. Химический потенциал – это парциальная молярная энергия Гиббса компонента в растворе.

| (1. 20) |
где: G – изобарно–изотермический потенциал раствора.
Химический потенциал данного компонента геометрически отображается тангенсом угла наклона касательной к кривой изобарно–изотермического потенциала раствора в точке соответствующей заданной концентрации.
Докажем, что для случая равновесия двух фаз равенство химических потенциалов компонентов отражает общая касательная к обеим кривым изобарно–изотермического потенциала, построенная для каждой фазы.
Рассмотрим двухкомпонентную систему А – В , в которой при некоторой температуре Т в равновесии находятся фазы жидких ( L ) и твердых ( S ) растворов (рис. 1. 3). Каждая из фаз образует непрерывный раствор во всем диапазоне концентраций и характеризуется собственной кривой зависимости свободной энергии Гиббса от состава: GL и GS соответственно.

|
| Рис. 1. 3. Обоснование двухфазного равновесия методом проведения касательной |
На рис. 1. 3 представлены:
GoSi и GoLi - свободные энергии Гиббса чистых компонентов в твердой ( S) и жидкой ( L ) фазах;
|
|
|
GL – концентрационная кривая изобарно-изотермического потенциала жидкого раствора;
GS – концентрационная кривая изобарно-изотермического потенциала твердого раствора;
аb – общая касательная
Предполагаем концентрацию компонента В ( xB ) независимой, т. е. состав фаз определяем по компоненту В ( xA+ xB=1 ).
Условия проведения общей касательной к двум кривым следующие:
Первое условие - это равенство угловых коэффициентов в точках касания, его можно записать в виде:

| (1. 21) |
Это условие необходимое, но недостаточное, т. к. касательные к двум кривым могут иметь одинаковый наклон, но на разных уровнях. Отсюда вытекает второе условие: принадлежность точек касания одной и той же прямой. Исходя из геометрии (рис. 1. 3), второе условие можно выразить уравнением:
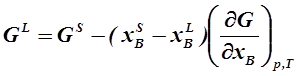
| (1. 22) |
Учитывая первое условие (1. 21), и, преобразуя выражение (1. 22), получим:
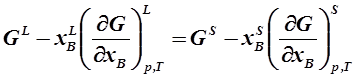
|
Используя для дальнейших преобразований уравнения Гиббса-Дюгема: G = xAμ A + xB μ B и xA(∂ μ A/∂ xB) + xB(∂ μ B/∂ xB) = 0 , и выражение xA+ xB=1 , получаем:

| (1. 23) |
Тогда: GL − xBL( μ LB− μ LA) = GS − xBS( μ SB − μ SA)
или GL − xBL μ LB − xАL μ LA + μ LA = GS − xBSμ SB − xАS μ SA + μ SA
т. е. μ LA = μ SA
Принимая в качестве независимой переменной концентрацию компонента А и повторяя ход рассуждений, получим:
| μ LВ = μ SВ |
Таким образом, проведение общей касательной позволяет однозначно зафиксировать составы сосуществующих в равновесии фаз xLB и xSB .
Установленное геометрическое условие равновесия, широко используется на практике при установлении возможных видов равновесия в двухкомпонентных системах.
Проекция отрезка общей касательной, заключенной между концентрациями равновесных фаз на соответствующую изотерму диаграммы Т – xi является коннодой, т. е. прямой соединяющей фигуративные точки с координатами, характеризующими сосуществующие в равновесии при данных условиях фазы.
|
|
|
На рис. 1. 4 представлена принципиальная схема установления фиксированного положения координат фигуративных точек, соответствующих равновесно сосуществующим фазам в двухкомпонентной двухфазной системе при температуре Т1. Обе фазы представляют собой неограниченные растворы компонентов А и В друг в друге, например, твердый раствор (S) и жидкий раствор (L).
Для того чтобы построить диаграмму состояния Т – xi термодинамическим методом, необходимо получить серию кривых Gp, T=f(xi) для различных температур. При этом напомним, что:
1. Чем выше температура, тем концентрационная зависимость свободной энергии Гиббса геометрически располагается ниже. Это следует из того, что температурная зависимость свободной энергииГиббса при увеличении температуры уменьшается.
2. При данной температуре ( р –const) устойчивой является фаза, имеющая более низкое значение изобарно-изотермического потенциала ( Gp, T ).

Рис. 1. 4. Принципиальная схема установления состава равновесных фаз в двухкомпонентной двухфазной системе
Перенося составы равновесных фаз при разных температурах на диаграмму в координатах состав − температура, можно построить диаграмму состояния двойной системы. Таким образом, метод расчета концентрационных зависимостей свободной энергии Гиббса позволяет теоретически обосновать разные варианты фазовых равновесий и построить соответствующие им диаграммы состояния. Отметим, что для получения надежных расчетов необходимо иметь информацию о взаимодействии компонентов во всех фазах данной термодинамической системы.
Эти рассуждения могут быть распространены на любые другие виды фазовых равновесий, например, между жидким раствором и газовой смесью. Для конденсированных систем, помимо важнейшего равновесия между твердой и жидкой фазами возможно существование равновесия между двумя жидкими фазами либо между двумя твердыми фазами в случае разрыва растворимости. Установление фиксированного положения координат равновесных фаз на диаграмме Т – х остается тем же самым, что и описано выше (рис. 1. 4).
На рис. 1. 5 схематически показано, как фиксируются координаты равновесных растворов a1 и a2, которые могут быть соответственно жидкими фазами или твердыми. В интервале концентраций от хВ1 до хВ2 растворы не устойчивы, т. е. происходит расслаивание и на кривой зависимости свободной энергии Гиббса появляется максимум. И в данном случае основной прием определения составов равновесных фаз при Т1 сводится к проведению общей касательной
|
|
|

Рис. 1. 5. Принципиальная схема установления состава равновесных фаз при наличии распада твердого раствора или расслоения жидкого раствора.
|
|
|


