 |
35. Взаимодействие одной субпопуляции антител с моновалентным антигеном. Расчет констант комплексообразования с помощью метода двойных обратных координат.
|
|
|
|
35. Взаимодействие одной субпопуляции антител с моновалентным антигеном. Расчет констант комплексообразования с помощью метода двойных обратных координат.
Взаимодействие антиген – антитело характеризуется через аффинность антител или равновестную константу иммунокомплекса. В простейшем случае взаимодействие одного центра связывания антитела с моновалентным антигеном может быть представлено схемой:
k1
Аг + Ат ↔ Аг*Ат, где Аг – свободный антиген, Ат – свободное антитело, Аг*Ат -
k-1 комплекс антиген – антитело, k1 и k-1 – константы скоростей ассоциации и диссоциации комплекса соответственно.
k1[Аг][Ат]=k-1[Аг*Ат], где [Аг], [Ат], [Аг*Ат] – равновесные концентрации Аг, Ат и комплекса Аг*Ат, соответственно, или при переходе к константе равновесия или внутренней аффинности (Ка): 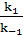 = Kа=
= Kа= 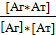 .
.
Равновестная константа образования Ка иммунокомплекса имеет размерность [л/моль].
Константа комплексообразования является термодинамическим параметром, характеризующим изменение свободной энергии взаимодействия антиген – антитело ∆ F, которое может быть рассчитано по следующей формуле: ∆ F = -RTInKa, где R- газовая постоянная, Т – абсолютная температура.
Общее изменение свободной энергии при комплексообразовании складывается их двух термодинамических величин – изменений энтальпии и энтропии: ∆ F=∆ H-T∆ S.
Реакция антиген-антитело протекает с выделением теплоты, но, как правило, изменение энтальпии невелико и составляет около 40 кДж/моль. Изменение энтропии в большинстве случаев положительно.
Если одна и та же популяция антител взаимодействует с двумя различными антигенами Аг1 и Аг2 с константами комплексообразования соответственно К1 и К2, то говорят, что данные антитела являются высоко специфическими по отношению к Аг1 и менее специфическими к Аг2.
|
|
|
На практике часто условно подразумлевают, что если константа равновесия процесса комплексообразования больше, чем 108 л/моль, то антитела являются высокоаффинными. Максимальные значения констант связывания характерны для антигенов, обладающих ярко выраженными гидрофобными свойствами или же взаимодействующих с активным центром антитела достаточно большой областью молекулы. Наименьшей эффективностью взаимодействия характеризуются антитела против углеводов (Ка< 106-108).
Антитела с более высокой специфичностью характеризуются более высоким значением константы внутренней аффинности.
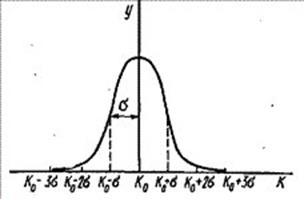
Графическое представление функции Гаусса
36. Получение конъюгатов белок-фермент путем ковалентного связывания
В химических методах получения конъюгатов белок-фермент можно выделить две группы по типу сшивающих реагентов – гомобифункциональных и гетеробифункциональных. Для получения конъюгатов белков с пероксидазой хрена широко используется перйодатный метод.
Перйодатный метод (метод Накане). Суть метода состоит в модификации пероксидазы хрена с образованием активных альдегидных групп, которые затем реагируют с аминогруппами антител с образованием основания Шиффа. Альдегидные группы в пероксидазе возникают при окислении перйодатом натрия углеводных компонентов фермента, аминогруппы которого предварительно или блокированы 1-фтор-2, 4-динитробензолом или протонированы. Для стабилизации основания Шиффа конъюгат иногда обрабатывают боргидрином натрия. Однако с увеличением стабильности конъюгата при обработке, ферментативная активность уменьшается на 20%. Пример: синтез конъюгата пероксидазы хрена с IgG.
|
|
|
Получение конъюгатов с помощью гомобифункциональных сшивающих реагентов. Используется глутаровый альдегид, который взаимодействует с ε -аминогруппами лизиновых остатков антител и фермента. Одновременно протекает несколько реакций, приводящих к появлению смеси продукта, содержащих более прочные химические связи, чем в простых основаниях Шиффа. Были разработаны одностадийный и двухстадийный методы синтеза. В одностадийном методе глутаровый альдегид добавляют к смеси фермента и белка, а в двухстадийном на первой стадии глутаровым альдегидом обрабатывают только фермент, удаляют избыток альдегида, а затем уже к модифицированному ферменту добавляют белок. Метод разработан для пероксидазы хрена, щелочной фосфатазы и глюкоамилазы. Недостаток: невысокий выход конъюгата (1-10%) и поляризация белков. Достоинство: простота, получаемый конъюгат удовлетворяет необходимым требованиям. Пример: синтез конъюгата тиротропина с щелочной фосфатазой.
Получение конъюгатов с помощью гетеробифункциональных сшивающих реагентов. Первым из реагентов был применен N-оксисукцинимидный эфир м-малеимидобензойной кислоты. С помощью этого реагента впервые был описан синтез конъюгата инсулина с β -D-галактозидазой. Метод заключается во введении малеимидных групп в молекулу белка при взаимодействии N-оксисукцинимидной группы сшивающего реагента с NH2-группой белка с образованием пептидной связи, которые затем уже реагируют с SH-группами фермента. Конъюгаты по этому методу получаются с высоким выходом, без образования каких-либо еще полимерных продуктов и имеют обычно состав 1: 1. Ферментативная активность в конъюгате полностью сохраняется. Пример: Синтез конъюгата дигоксин –уреаза с помощью малеимидобензойной кислоты.
Еще один реагент N-оксисукцинимидный эфир малеимид, который более стабилен, чем мелеимидобензойная кислота. Синтез проводят при pH 7. Малеимидные соединения недостаточно хорошо растворимы в водных растворах и иногда выпадают в осадок во время проведенных реакций.
|
|
|


