 |
2.3. Момент инерции однородного шара.
|
|
|
|
2. 3. Момент инерции однородного шара.
Приведём без вывода результат вычисления момента инерции однородного шара относительно оси, проходящей через его центр масс:


2. 4. Теорема Штейнера.
Расчет моментов инерции тела даже правильной формы, если ось не проходит через центр масс тела, затруднен. В этом случае удобно пользоваться теоремой Штейнера:
Момент инерции тела относительно произвольной оси 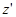 равен сумме момента инерции
равен сумме момента инерции  относительно оси
относительно оси  , параллельной заданной и проходящей через центр масс, и произведения массы М тела на квадрат расстояния а между осями:
, параллельной заданной и проходящей через центр масс, и произведения массы М тела на квадрат расстояния а между осями:
VI. Основы молекулярной физики
Молекулярная физика изучает физические свойства тела в зависимости от его макроскопического строения и характера движения, образующих это тело атомов, молекул и ионов с учетом их взаимодействия.
Основой молекулярной физики является молекулярно-кинетическая теория вещества (МКТ). Согласно МКТ все вещества состоят из частиц (атомов, молекул, ионов), имеющих линейные размеры 10-10 - 10-7 м и находящихся в непрерывном движении, интенсивность которого возрастает с увеличением температуры. Между частицами существуют силы взаимодействия (притяже-ния и отталкивания), имеющие электромагнитную природу.
6. 1. Понятия молекулярно - кинетической
теории вещества
Вещества состоят из химических элементов, которые, вступая во взаимодействия, соединяются в строго определенных пропорциях, причем массы реагирующих веществ сохраняются.
Атомом называется наименьшая часть химического элемента, сохраняющая его химические свойства.
Атомной массой Аг называется относительная масса атома. За атомную единицу массы (а. е. м. ) принята 1/12 массы атома изотопа углерода 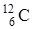 (1 а. е. м. = 1, 66× 10-27 кг).
(1 а. е. м. = 1, 66× 10-27 кг).
|
|
|
Молекулой называется наименьшая устойчивая частица данного вещества, обладающая его основными химическими свойствами. Она состоит из одного или нескольких атомов одинаковых или различных элементов.
Количество вещества определяется числом специфических структурных элементов - молекул, атомов и ионов, из которых состоит вещество. Единица количества вещества называется молем: моль равен количеству вещества, в котором содержится столько частиц, сколько атомов в изотопе углерода 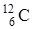 массой 0, 012 кг. Это основная единица СИ.
массой 0, 012 кг. Это основная единица СИ.
Моли любых веществ содержат одинаковое число частиц NА = 6, 02× 1023 моль-1 (постоянная Авогадро). Эта константа играет связующую роль между макро- и микро характеристиками вещества.
Молярной массой m называется масса моля вещества.
Число молей вещества n, имеющего массу m и объем V равно
n = m/m, n = V/Vm. (6. 1)
Масса одной молекулы может быть найдена по формуле
m0 = m/NА. (6. 2)
Например, у воды m0 = 3× 10-26 кг.
Число молекул в единице объема называется концентрацией n и определяется из соотношений
n =  , n =
, n = 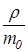 , n =
, n =  . (6. 3)
. (6. 3)
Число молекул N в данной массе вещества m равно
N =  =
=  . (6. 4)
. (6. 4)
6. 2. Идеальный газ. Основное уравнение МКТ
идеального газа
Идеальным газом называется газ, в котором молекулы большую часть времени движутся как свободные частицы, а их взаимодействие сводится в соударениям между собой. При этом длина свободного пробега - расстояние между двумя последующими соударениями молекул - намного меньше размеров сосуда, а объем, занимаемый самими молекулами пренебрежимо мал. Данные условия выполняются при нормальных физических условиях для газов, молекулы которых имеют сравнительно простое строение (H2, O2, N2, CO2).
|
|
|
Нормальные физические условия: давление р0 = 1, 013× 105 Па, температура Т0 = 273, 15 К. Основное уравнение МКТ идеального газа выводится на основе модели идеального газа и связывает макроскопический параметр - давление р со средним значением микроскопической величины - кинетической энергии поступательного движения молекулы
 , (6. 5)
, (6. 5)
 , (6. 6)
, (6. 6)
 , (6. 7)
, (6. 7)
где  - среднеквадратичная скорость поступательного движения молекул, vi - скорость i - той молекулы,
- среднеквадратичная скорость поступательного движения молекул, vi - скорость i - той молекулы,  =
= 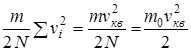 - средняя кинетическая энергия молекулы, m, r - масса и плотность газа, N и n - число и концентрация молекул. Средняя кинетическая энергия молекулы газа пропорциональна температуре и определяется формулой
- средняя кинетическая энергия молекулы, m, r - масса и плотность газа, N и n - число и концентрация молекул. Средняя кинетическая энергия молекулы газа пропорциональна температуре и определяется формулой
 =
= 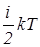 , (6. 8)
, (6. 8)
где i - число степеней свободы молекулы, Т - термодинамическая температура, k = 1, 38× 10-23 Дж/К - постоянная Больцмана.
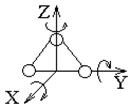
Числом степеней свободы молекулы (тела) называется число независимых координат, определяющих положение молекулы (тела) в пространстве. На каждую степень свободы приходится энергия равная kТ/2. Молекула одноатомного газа рассматривается как свободная материальная точка, движущаяся только поступательно. Она обладает тремя степенями свободы i = 3 (рис. 6. 1, а). Число степеней свободы жесткой двухатомной молекулы i = 5, из них поступательных - 3 и 2 вращательных степени свободы (рис. 6. 1, б). Молекулы 3-х и более атомных газов имеют 6 степеней свободы (3 поступательных, 3 вращательных, рис. 6. 1, в).

| 
| 
|
| а) | б) | в) |
Рис. 6. 1
Из выражения  =
= 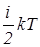 следует, что термодинамическая температура равновесного состояния системы является мерой средней кинетической энергии теплового движения ее частиц. Средняя кинетическая энергия частиц пропорциональна термодинамической температуре системы. Если Т ® 0, то
следует, что термодинамическая температура равновесного состояния системы является мерой средней кинетической энергии теплового движения ее частиц. Средняя кинетическая энергия частиц пропорциональна термодинамической температуре системы. Если Т ® 0, то  ® 0. Температура Т = 0 К называется абсолютным нулем температуры.
® 0. Температура Т = 0 К называется абсолютным нулем температуры.
В СИ единицей измерения температуры является Кельвин. Термодинамическая температура Т связана с температурой Цельсия t соотношением
|
|
|
Т = (t + 273, 15) К.
Среднеквадратичная скорость поступательного движения молекул газа равна
 , (6. 9)
, (6. 9)
где R = 8, 314 Дж/(моль× К) - универсальная газовая постоянная.
|
|
|


