|
7.2. Внутренняя энергия. 7.3. Работа в термодинамике
|
|
|
|
7. 2. Внутренняя энергия
Внутренней энергией тела (термодинамической системы) называется энергия, зависящая только от термодинамического состояния тела (системы). Она является однозначной функцией параметров состояния. Изменение внутренней энергии при переходе системы из состояния 1 в состояние 2 равно DU = U2 - U1 и не зависит от вида процесса перехода. При совершении системой кругового процесса (цикла) изменение внутренней энергии DU = 0.
Внутренняя энергия системы, в общем случае, зависит от характера движения и взаимодействия частиц в системе, складывается из кинетической энергии теплового хаотического движения частиц, образующих систему (молекул, атомов, ионов и др. ), потенциальной энергии частиц, обусловленной силами их межмолекулярного взаимодействия, энергии электронов в электронных оболочках атомов и ионов, внутриядерной энергии.
Началом отсчета внутренней энергии (U = 0) полагают состояние систе-мы при абсолютном нуле (Т = 0).
Внутренняя энергия идеального газа полностью определяется его термодинамической температурой
 (7. 1)
(7. 1)
С учетом уравнения Менделеева - Клапейрона
|
Рис. 7. 1 |
 (7. 2)
(7. 2)
где p и V - соответственно давление и объем газа.
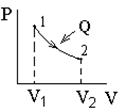
Изменение внутренней энергии идеального газа при переходе из начального состояния 1 в конечное 2 (рис. 7. 1) равно
 (7. 3)
(7. 3)
7. 3. Работа в термодинамике
Количество энергии, переданное системе внешними телами при силовом воздействии между ними, называется работой, совершенной над системой. Необходимым условием совершения телом (или системой) работы является перемещение тела или его частей при наличии действующих сил.
|
|
|
|
Рис. 7. 2 |
Различают работу, совершаемую системой над внешними телами (А > 0), и работу, совершаемую внешними телами над системой (А/ < 0).
Работой расширения называется работа, которую система совершает против внешнего давления (А > 0).
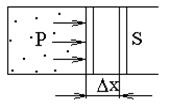
Элементарная работа, совершаемая идеальным газом (рис. 7. 2) при перемещении поршня на бесконечно малое расстояние Dх равна
DАi = FDх = pSDх = pDVi, (7. 4)
где p - давление, F = pS - сила давления,
S - площадь поршня, DVi = SDх - бесконечно малое приращение объема.
При расширении газа DVi > 0, газ совершает положительную работу (DАi = 0), при сжатии газа DVi < 0 - работа отрицательна (DАi < 0).
|
Рис. 7. 3 |
Графически работа равна площади криволинейной трапеции, ограниченной осью абсцисс, ординатами и графиком давления, построенного в p - V координатах (рис. 7. 3). Работа при изменении объема зависит от начального (p1, V1, T1), конечного состояния газа (p2, V2, T2) и характера перехода из состояния 1 в состояние 2.
При изохорном процессе (V = const) газ работу не совершает А = pDV = 0 (рис. 7. 4, а).
При изобарном процессе (p = const) (рис. 7. 4, б) работа расширения газа
А = p(V2 - V1) (7. 5)
или с учетом уравнения Менделеева - Клапейрона
 . (7. 6)
. (7. 6)
При изотермическом процессе (Т = const) (рис. 7. 4, в) работа расширения газа
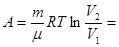
 . (7. 7)
. (7. 7)
7. 4. Первое начало термодинамики
Существуют две формы изменения внутренней энергии системы - работа и теплота. В форме работы системе передается энергия упорядоченного движения тела, переходящая в энергию хаотического движения частиц системы. В форме теплоты происходит передача энергии при непосредственном обмене энергией между хаотически движущимися частицами взаимодействующих систем. Мерой изменения энергии, переданной в форме теплоты, является количество теплоты.
|
|
|
|
а б в Рис. 7. 4 |
Закон сохранения энергии, формулировка которого учитывает особую форму ее передачи путем теплообмена, называется первым началом термодинамики. Согласно данному закону, в тепловых процессах изменение внутренней энергии системы равно сумме совершенной над системой работы А ’ и полученного ею количества теплоты Q
DU = A¢ + Q (7. 8)
или
Q = DU + A, (7. 9)
т. е. количество теплоты, полученное системой, расходуется на изменение внутренней энергии DU системы и на работу системы против внешних сил.
В круговом процессе DU = 0 и, следовательно,
А = Q, (7. 10)
т. е. работа, совершаемая в цикле, не может превосходить подведенного количества теплоты. Поэтому невозможно построить периодически действующий двигатель, совершающий работу, большую подводимой извне энергии.
В таблице 7. 1. приведены графики изопроцессов и соответствующие формулы для теплоты, работы и изменения внутренней энергии, а также теплоемкости.
Таблица 7. 1
| Изохорический процесс (V = const) | Изобарический процесс (p = const) | Изотермиический процесс (Т= const) |


|  Q = DU+А,
Q = DU+А,


|  Q =А,
DU = 0,
Q =А,
DU = 0,
  СТ ® ¥ .
СТ ® ¥ .
|
|
|
|