 |
6.3. Уравнение состояния идеального газа
|
|
|
|
6. 3. Уравнение состояния идеального газа
Уравнением состояния газа называется функциональная зависимость давления газа от его объема и температуры
p = f (V, T). (6. 10)
Из уравнений (6. 5) и (6. 8) при i = 3 следует
p = nkT (6. 11)
или с учетом, что n =  ,
,
pV = NkT. (6. 12)
Данное уравнение является уравнением состояния идеального газа. Учитывая уравнение (6. 4), получим уравнение Менделеева-Клапейрона
pV = 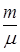 RT, (6. 13)
RT, (6. 13)
где R = 8, 31 Дж/(моль. К) - универсальная газовая постоянная.
Из уравнения состояния идеального газа вытекает ряд следствий.
1. Закон Авогадро: в равных объемах разных газов при одинаковых давлениях и температурах содержится одинаковое число молекул
N =  .
.
Так в 1 м3 любого идеального газа при нормальных условиях содержится Nл = 2, 7. 1025 молекул (Nл - число Лошмидта).
2. Закон Дальтона: в состоянии равновесия давление смеси идеальных газов равно сумме давлений компонент смеси 
 , (6. 14)
, (6. 14)
где 
 ,
,
Ni - число частиц i - компоненты.
Полное число молекул смеси N = å Ni, а температура Т в состоянии равновесия для каждой компоненты одна и та же.
3. Объединенный газовый закон
 const. (6. 15)
const. (6. 15)
6. 4. Изопроцессы в идеальных газах
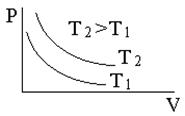
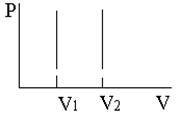
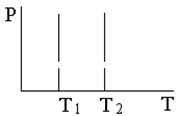
Изопроцессами называют процессы, происходящие в системе с постоянной массой (m = const) при каком-либо одном неизменном параметре состояния. В таблице 6. 1 приведены законы изопроцессов в идеальных газах и их графики.
Таблица 6. 1
| Изотермический процесс (T = const) pV = const | Изобарический процесс (p = const) V/T = const | Изохорический процесс (V = const) p/T = const |
| 
| 
|
| 
| 
|

| 
| 
|
|
|
|
VII. Основы термодинамики
7. 1. Термодинамические процессы
Тело, состоящее из большого числа частиц, называется макроскопической системой. Ее размеры намного больше размеров атомов и молекул, взаимодействие такой системы с окружающими телами определяется макроскопическими параметрами.
Если параметры системы не изменяются со временем, и отсутствуют внешние взаимодействия, то состояние системы называется термодинамически равновесным, а параметры, характеризующие состояние такой системы, называются термодинамическими параметрами.
Система, не обменивающаяся энергией и веществом с другими системами, называется изолированной. Такая система с течением времени приходит в состояние термодинамического равновесия, из которого самопроизвольно не может выйти (основной постулат термодинамики).
Изменение состояния системы называется термодинамическим процессом. Если в процессе система проходит непрерывный ряд равновесных состояний, то процесс называется равновесным, при этом состояние системы изменяется бесконечно медленно. Все реальные процессы являются неравновесными, т. к. протекают с конечной скоростью.
В термодинамике температура Т характеризует направление теплообмена между телами. В равновесном состоянии температура всех объектов, входящих в систему, одинакова. Температура является мерой средней кинетической энергии теплового движения молекул и атомов. Понятие температуры для неравновесной системы не имеет смысла.
Температура, определяемая по абсолютной термодинамической шкале температур, называется термодинамической, ее единицей является Кельвин. Нижней точкой термодинамической шкалы температур является абсолютный нуль.
|
|
|
|
|
|


