 |
Дифференциация популяций по грузу наследственных болезней 20 глава
|
|
|
|
Гены главного комплекса гистосовме- стимости (МНС) класса II расцениваются как возможные модификаторы легочного фенотипа посредством воздействия на уровни специфичных IgE и степени чувствительности к хронической колонизации Р aeruginosa
Фактор некроза опухолей а (TNF-а) - потенциальный иммуномодулятор и про- воспалительный цитокин Полиморфизмы в гене TNF-«участвуют в патогенезе различных аутоиммунных и инфекционных болезней Двухаллельный полиморфизм (-308G>A) влияет на уровень транскрипции TNF а Более тяжелое поражение легких описано у больных MB, имеющих аллель (-308 А) ассоциированный с высокой экспрессией TNF-a [11]
Оксид азота II (NO) - важный фактор в клеточной сигнализации, уничтожении патогенов и релаксации гладкой мускулатуры NO синтезируется группой энзимов, называемых синтезами оксида азота II (NOS) Поскольку NO играет важную роль в бактериальной активности, снижение уровня NO может привести к повышению риска инфекции Уровень выделяемого NO при МБ снижен При анализе размера три- нуклеотидного ААТ-повтора в интроне 20 гена NOS1 у МВ-больных было показано, что снижение образования NO, обусловленное аллелями с большим числом повторов в гене NOS1, делает больных МБ более чувствительными к колонизации дыхательных путей Р aeruginosa и Aspergillus fumigatus [6]
Тяжелые поражения легких описаны у больных МБ, имеющих низкие уровни маннозо-связывающего лектина 2 (MBL2), протеина, участвующего в опсо- низации и фагоцитозе микроорганизмов [6, 9] Показано, что MBL-аллели, обусловливающие низкую сывороточную кон центрацию MBL, ассоциируют с повышенным риском инфекций различного типа Три миссенс-мутации в экзоне 1 гена MBL независимо вызывают низкую концентрацию MBL в сыворотке Gly54Asp (G54D), Gly57Glu (G57E) и Arg52Cys (R52C) Несколько нуклеотидных замен в промотор- ном регионе также могут влиять на уровень сывороточного MBL Смертность и необходимость в трансплантации легких были выше у больных с вариантными аллелями MBL
|
|
|
При анализе полиморфизмов в гене трансформирующего фактора роста pi (TGF-p1) у МВ-больных, имеющих одинаковый генотип, обнаружили, что мутация в кодоне 10 этого гена является фактором риска развития более тяжелого поражения у больных MB [6, 9]
Ряд исследований касались генов, кодирующих белки сурфактантного слоя дыхательных путей Высокий риск бактериальной колонизации описан у больных MB с мутациями в генах 1 и 2 сурфактантных белков Smith et al [11] обнаружили соле- чувствительную антибактериальную активность в эпителиальном слое дыхательных путей, обусловленную несколькими антимикробными протеинами, такими как бета-дефенсины человека 1 и 2 (hBD1 и hBD2), лактоферрин, лизоцим, гистатин и кателицидин hBD1 и hBD2 считаются модуляторами инфекции дыхательных путей Предполагают, что экспрессия hBD2 может быть индуцирована воспалением, тогда как hBD1, по-видимому, включается во внутренний защитный ответ и экспресси- руется независимо от воспаления
Изучение иммунного статуса у больных MB показало, что гуморальное звено иммунитета у этих больных не страдает и, как правило, вызывает гипериммунный ответ Однако у них наблюдаются снижение сек- теторного компонента sIGA, ослабление противовирусного иммунитета, нарушение интерферонообразования, уменьшение количества макрофагов и ухудшение их функции («спящие макрофаги»), угнете- ниє фагоцитарной функции лейкоцитов [2] Эти изменения в иммунном статусе больных MB диктуют необходимость максимального приближения лечебных и реабилитационных мероприятий к домашним и/или амбулаторным условиям, о чем будет сказано ниже
Клиническая картина. Изменения со стороны бронхолегочной системы обычно появляются в первые недели или месяцы жизни ребенка в виде гипертрофии слизистых желез бронхов и гиперплазии бокаловидных клеток В результате этих ранних изменений развивается обтурация периферических дыхательных путей Вязкий бронхиальный секрет, представляющий собой концентрированный перенасыщенный раствор, тормозит движения ресничек эпителия бронхов, а его компоненты легко выпадают в осадок В результате нарушается механизм самоочищения бронхов Это способствует росту патогенной флоры и развитию бронхиолитов и бронхитов В течение первого года жизни или позднее, часто после вирусной инфекции, снижающей эффективность локальных механизмов проти- вомикробной защиты, в нижние отделы респираторного тракта проникает большое количество патогенных микробов [2, 11]
|
|
|
Хроническая респираторная инфекция обычно развивается очень рано и играет определяющую роль в заболеваемости и смертности, являясь причиной летального исхода более чем у 90% больных [3, 13]
К наиболее распространенным бактериальным штаммам относятся Staphylococcus aureus (St aureus), Haemophilus influenzae (H mfl) и P aeruginosa (мукоид- ной и немукоидной форм) В последнее время возросла роль Burkholderia cepacia (В сер), характеризующаяся полирезистентностью к антибиотикам, Е coll, Klebsiella pneumoniae, Stenotrophomonas maltophilia, Acinetobacter anitratus, Entero- bacter spp, Alcaligenes spp и ряда других [2, 3, 12, 14]
Патогенез хронической Р aeruginosa легочной инфекции при MB классифицируется как III тип реакции гиперчувствительности, характеризующийся продукцией антител против большого числа бактериальных антигенов, иммунных комплексов и нейтрофилов [15, 16] Колонизация Р aeruginosa вызывает выраженный воспалительный ответ, сопровождаемый высвобождением большого числа цитокинов, таких как интерлейкин-8 (ИЛ-8), который является хемоатрактантом нейтрофилов Изначально немукоидные штаммы вскоре трансформируются в мукоидные с форми рованием биофильма вокруг микроколоний, что делает их резистентными к фагоцитам и ограничивает пенетрацию антибиотиков [16]
Хронической Р aeruginosa инфекции предшествуют месяцы и даже годы интер- митирующей или низкой степени колонизации, когда либо совсем нет, либо слабо выражена симптоматика бактериальной инфекции нижних дыхательных путей Повышение уровня специфических антител может отражать антигенную нагрузку из- за пролиферативного роста Р aeruginosa микроколоний Альтернативно, взаимодействие специфических антител с Р aeruginosa антигеном может активировать комплемент с привлечением и активацией нейтрофилов Высокореактивные образцы молекулярного Ог, продуцируе мого во время НАДФ-зависимых радика лов Ог взрыва этих клеток может активи ровать Р aeruginosa гены, кодирующие продукцию альгината
|
|
|
Хроническое воспаление неизбежно приводит к повреждению легочных структур Выраженное воспаление определяется уже у трети больных MB грудного возраста В ответ на воспаление стенки бронхов реагируют утолщением, изменяя геометрию, и увеличением числа гладко- мышечных клеток бронхов, причем воспалительный процесс в периферических дыхательных путях более выражен, чем в крупных бронхах У больных MB, подвергнувшихся трансплантации, толщина сте нок бронхов на периферии более чем в три раза толще, чем у курильщиков, оперированных по поводу новообразования легких. Утолщение стенки бронхов у больных MB в конечной стадии болезни столь же выражено, как и у больных бронхиальной астмой, умерших в астматическом статусе.
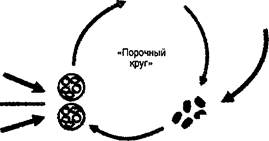
Рост бактерий в бронхиальном дереве у больных MB индуцирует значительный выброс нейтрофилов, и в ответ на воспаление возрастает экспрессия провоспали- тельных цитокинов ИЛ-1В, TNF-a, ИЛ-6, ИЛ-8. Транскрипция провоспалительных цитокинов регулируется ядерным фактором - NF-kB и AF^-транскрипциогенным фактором белка активатора. Повышенная экспрессия этих цитокинов сопровождается уменьшением экспрессии ИЛ-10-анти- воспалительного цитокина [30]. Гиперпродукция провоспалительных цитокинов стимулирует мобилизацию нейтрофилов и их скопление в бронхолегочной системе. Дериваты этих гибнущих нейтрофилов - эластаза, протеаза, оксидазы и ци- токины разрушают легочные структуры, воздействуя на эластин и структурные белки. Кроме того, нейтрофильная эластаза - потенциальный стимулятор продукции ИЛ-8 и бронхиального секрета. Клиническим проявлением порочного круга: инфекция - воспаление и повреждение тканей легких, является прогрессирующее снижение функциональных показателей дыхания [17].
|
|
|
У 85-95% больных MB встречается зк- зокринная недостаточность поджелудочной железы, которая проявляется в основном в нарушении ассимиляции жира и сте- аторее. Нарушение стула встречается уже с первых дней жизни у 47,3%, а к году - у 76,6% больных MB [20,21].
В связи с этим среди больных MB широко распространен дефицит жирорастворимых витаминов, бета-каротина и полиненасыщенных жирных кислот (ПНЖК). Нарушение всасывания липофильных ан- тиоксидантов усугубляет системный окси- дативный стресс, усиливает повреждение органов и тканей свободными радикалами, а также способствует чрезмерному воспалительному ответу. Оксидативный стресс и, как следствие, интенсивное пе- рекисное окисление липидов могут усугублять недостаточность ПНЖК, что приводит к изменению мембранного состава клеток иммунной системы и нарушает их активность.
Поражение гепатобилиарной системы является прямым следствием базисного дефекта при MB. Несмотря на то, что признаки фиброза той или иной степени выраженности встречаются практически у всех больных MB, однако эти изменения только у 5-10% больных приводят к развитию билиарного цирроза печени с синдромом портальной гипертензии, требующего хирургического лечения [3, 23]. Эхографи- ческие признаки изменения гепатобилиарной системы наблюдались нами у 92% больных MB. Желчно-каменная болезнь отмечалась у 1,9% больных, причем частота холелитиаза не зависела от пола и нарастала с увеличением возраста пациентов: до 6 лет желчно-каменная болезнь не встречалась ни у одного ребенка, в возрасте от 7 до 14 лет - у 2,33%, старше 15 лет - у 4,08%. Из 423 детей, больных MB, у 32 (7,5%), по данным комплексного кли- нико-функционального обследования, был выявлен билиарный цирроз печени с развитием синдрома портальной гипертензии у 54%. Средний возраст больных при установлении диагноза цирроза печени составил - 8,5 г. (от 3 лет 3 мес до 14 лет 7 мес). При развитии синдрома портальной гипертензии возраст больных варьировал от 4 лет 1 мес до 14 лет 6 мес. Цирроз печени осложнился печеночной недостаточностью у 3 наблюдавшихся больных.
Диагностика. Диагноз MB базируется на наличии хронического бронхолегочного процесса, кишечного синдрома, положительного потового теста, MB у сибсов. При этом для установления диагноза муковис- цидоза достаточно сочетания любых двух из этих четырех признаков. Недавно разработаны новые критерии диагностики MB, включающие два диагностических блока: 1) один из характерных клинических симптомов - это или случай муковис- цидоза в семье, или положительный результат неонатального скрининга по имму- нореактивному трипсину; 2) повышенная концентрация хлоридов в поте (> 60 ммоль/л) или две идентифицированные мутации, или положительный тест по измерению разности назальных потенциалов (в пределах от -40 до -90 mV). Диагноз считается достоверным, если присутствует хотя бы по одному критерию из каждого блока [18].
|
|
|
Ранняя адекватная терапия улучшает течение и прогноз заболевания, позволяет избежать развития необратимых брон- холегочных поражений. Своевременная коррекция нарушений ЖКТ предупреждает развитие гипотрофии. Установленный в ранние сроки диагноз MB позволяет избежать часто ненужных, дорогостоящих диагностических и терапевтических мероприятий. Своевременное вовлечение родителей в лечебно-реабилитационный процесс существенно влияет на качество жизни данного контингента больных. Применение пренатальной диагностики в перспективных и информативных семьях является основой первичной профилактики MB, уменьшает количество новых больных с этим серьезным заболеванием. В настоящее время в России диагностика муковисцидоза проводится только в так называемых группах «поиска» или «риска» [2, 12, 19].
Лечение больных MB предпочтительно проводить в специализированных центрах. Оно не ограничивается лекарственным лечением: больным MB требуется комплексная медицинская помощь при активном участии не только клиницистов, но и медицинских сестер, диетологов, физиотерапевтов, психологов и социальных работников.
Комплексное лечение больных MB включает применение лечебной физкультуры (физиотерапии, кинезитерапии), му- колитических средств, антимикробных препаратов, ферментов поджелудочной железы, витаминов, диеты, а также лечение осложнений MB.
Основой терапии являются в настоящее время микросферические панкреатические ферменты с рН-чувствительной оболочкой, позволяющие скорректировать имеющийся у больных MB синдром маль- абсорбции и нормализовать физический статус [20].
Панкреатические ферменты применяются во время еды - либо вся доза непосредственно перед приемом пищи, либо в два приема - перед едой и между первым и вторым блюдами. Капсулы, содержащие мелкие, покрытые оболочкой (мини) микросферы (Креон 10 000 и Креон 25 000), можно вскрывать и принимать с небольшим количеством пищи [2, 20].
Диета больных MB по составу должна быть максимально приближенной к нормальной, богатой белками, без ограничений в количестве жиров и предусматривать употребление доступных продуктов, имеющихся в каждом доме. Считается, что количество калорий в рационе больного MB должно составлять 120-150% от калоража, рекомендуемого здоровым детям того же возраста, 35-45% всей энергетической потребности должно обеспечиваться жирами, 15% - белком и 45-50% - углеводами. Этот подход основан на возможности компенсации стеато- реи и восстановлении адекватной ассимиляции жира путем применения высокоэффективных современных панкреатических ферментов. При их применении в большинстве случаев удается компенсировать стеаторею и улучшить нутритив- ный статус больных без применения специализированных лечебных пищевых добавок [20, 21].
До настоящего времени не существует методов лечения, способных предотвратить развитие цирроза печени у больных MB. В последние годы для лечения холестерин-позитивных желчных камней с успехом используется урсодезоксихолевая кислота (УДХК). Длительное (более 3 мес) применение УДХК в высоких дозах (20-30 мг/кг/сут) у больных MB оказывает холеретическое, холекинетическое, цито- протективное, антиоксидантное и имму- номодулирующее действие [3, 22, 23]. УДХК в Российском центре муковисцидо- за с 1994 г. назначается всем больным MB с гепатомегалией, синдромом холестаза, циррозом печени с наличием и без синдрома портальной гипертензии. Около 30% больных MB из различных регионов России и 80% детей из Москвы получают УДХК, чаще урсосан, в дозе 15-30 мг/кг/сут постоянно в комплексе базисной терапии MB (длительность непрерывной терапии у некоторых детей превышает 6 лет) [21, 22]
Для предотвращения кровотечений из варикозно-расширенных вен пищевода при синдроме портальной гипертензии на фоне цирроза печени применяют эндоскопическое склерозирование или лигирова- ние, трансюгулярное интрапеченочное портосистемное шунтирование, с последующей трансплантацией печени. В настоящее время в России возможно проведение частичной трансплантации печени от живых доноров. Операции портосистемно- го шунтирования, несмотря на их эффективность в предотвращении гастроэзофа- геальных кровотечений, не показаны из- за высокого риска развития печеночной недостаточности [25]. При развитии синдрома гиперспленизма альтернативой может быть проведение частичной сплензк- томии [24-26].
Известно, что причиной неблагоприятного исхода у 95% больных MB является бронхолегочная патология, в борьбе с которой очень важна антибактериальная терапия.
В частности, выбор антибиотика определяется видом микроорганизмов, выделяемых из бронхиального секрета больного MB, и их чувствительностью к антибиотикам. Микробиологический анализ мокроты у больных MB следует проводить не реже одного раза в 3 мес.
Микробный пейзаж бронхиального секрета при MB на ранних этапах заболевания обычно представлен стафилококком (61%), гемофильной палочкой (46%). В возрасте старше 3 лет начинает доминировать си- негнойная палочка (77%), при этом чувствительность к антибиотикам существенно варьирует [2, 12, 19].
Учитывая снижение в последние годы чувствительности Р aeruginosa к цефтази- диму из-за его длительного непрерывного применения, используют новые антибактериальные препараты цефалоспоринового ряда и других групп (карбапенемы, пени- циллины, активные по отношению к P. aeruginosa) в сочетании с аминогликози- дами (табл. 4 1.9.3.).
Определенные надежды на более успешную борьбу с P. aeruginosa появились при длительном назначении субтерапевтических доз макролидов, подавляющих продукцию альгината, а также разрушающих биофильм, защищающий микроколонии P. aeruginosa [12, 27-29].
Наши 3-летние клинико-функциональ- ные наблюдения за 70 больными, получающими пульмозим, доказали его высокую эффективность. У них снизилась частота респираторных эпизодов (на 29%), уменьшились тяжесть течения бронхолегочных обострений, частота и длительность госпитализаций и курсов антибактериальной терапии. Отмечены клинически значимое увеличение весоростового индекса на 7%, улучшение показателей ФЖЕЛ и ОФВ1 на 4 и 3%, соответственно, при их ежегодном естественном снижении на 4-6% в контрольной группе. На фоне терапии пульмозимом снизилась степень обсеменения мокроты S. aureus и P. aeruginosa [2, 3, 12].
Одним из важных и малозатратных компонентов терапии при MB является кинези- терапия, основной целью которой является очищение бронхиального дерева от вязкой мокроты. Чаще других используются перкуссия и вибрация грудной клетки (клолфмассаж), активный цикл дыхания и аутогенный дренаж. Разработаны дыхательные упражнения с помощью «флаттера», «корнета» и «ПЕП-маски» [10].
В Москве приказом «Об обеспечении лекарственными средствами детей, больных муковисцидозом, и их реабилитации в условиях детских городских поликлиник» введена в действие программа по реабилитации и лекарственному обеспечению больных муковисцидозом. На основании этого приказа 110 больных Москвы получают по бесплатным рецептам жизненно необходимые лекарственные препараты, антибиотики, муколити- ки, микросферические ферменты поджелудочной железы, гепатопротекторы, витамины.
Дети находятся на активном диспансерном наблюдении - 4 раза в год проводятся плановые осмотры больных по протоколу.
Наряду с антибиотиками, больным MB назначают иммунокорректоры. К ним относятся глюкокортикоиды местного и системного действия, нестероидные противовоспалительные средства (НПВС) и макролиды, в частности, антибиотик ази- тромицин.
Азитромицин тормозит образование альгината биолленок путем ингибирова- ния гуанозин-Р-манноза-дегидрогеназы - одного из ферментов, необходимого для синтеза альгината. Предполагают, что макролиды, наряду с препятствием адгезии P. aeruginosa, подавляют образование биофильма синегнойной палочкой, облегчая фагоцитирование бактерий нейтрофи- лами и повышая чувствительность микроорганизмов к бактерицидному действию сыворотки. Азитромицин назначают 2 раза в неделю по 250 мг детям весом менее 40 кг и по 500 мг с весом более 40 кг в течение 6-12 мес.
Результаты проведенных нами клинических наблюдений и специальных исследований показали, что длительный прием малых доз макролидов замедляет про- грессирование хронического бронхоле- гочного процесса у больных MB, что позволяют рекомендовать их больным MB с хронической колонизацией синегнойной палочкой [27].
Таблица 4193 Антибиотики, примопяомыо у больпых муковисцидозом при обпаружопии в броихиальпом секрете P. aeruginosa
| Антибиотик | Доза в сутки | Суточные дозы | Путь | Число приемов |
| для детой | для взрослых | введения | вдень | |
| Амикацин | 30-35 мг/кг в день | 350-450 мг 2 раза в день | В/в | 1-2 |
| Концентрация в сыворотке крови через 1 ч после введения не более 30 мкг/мл | ||||
| Гентамицин, тобрамицин | 8-12 мг/кг в день | 10 мг/кг | В/в | 1-2 |
| Концентрация в сыворотке крови через 1 ч после введения 3-4 дозы не более 10-12 мкг/мл | ||||
| Ципрофлоксацин | 15-40 мг/кг в день | 1,5-2 г в день | Внутрь | |
| 10 мг/кг в день | 400 мг 2 раза в день | В/в | ||
| Цефтазидим | 150-300 мг/кг в день | 6-9 г в день | В/в | 2-3 |
| Цефепим | 150 мг/кг в день | 6 г в день | В/в | |
| Пиперациллин | 200-300 мг/кг в день | 12-16 г/день | В/в | |
| Пиперациллин/ | 90 мг/кг в день | 2,25-4,5 3 р в день | В/в | |
| тазобактам | ||||
| Тикарциллин | 200-400 мг/кг в день | 12-16 г/день | В/в | |
| Тикарциллин/амоксициллин | ||||
| Азлоциллин | 300 мг/кг в день | 15 г/день | В/в | 3-4 |
| Карбенициллин | 500 мг/кг в день | В/в | ||
| Азтреонам | 150-250 мг/кг в день | 8 г/сут | В/в | |
| Имипенем | 50-75 мг/кг в день | 2-4 г/сут | В/в | 3-4 |
| Меропенем | 60-120 мг/кг в день | 3-6 г/сут | В/в | |
| Коломицин | 50 тыс ЕД/кгвдень | 2 млн ЕД | В/в |
Генная терапия. Муковисцидоз явился одним из первых заболеваний, при кото-
ДНКаза Гельзолин Ацетилцистеин

АТФ, УТФ
Генная терапия
Циклопентилксантин
Фенилбутират
Аминогликозиды

Дефектный ген
Дефектный белок (МВТР)
Амилорид ♦
Na+
I
/
I
Кинезитерапия
Антипротеазы
Пероральные, аэрозольные и в/в антибиотики
Накопление клеток воспаления и выброс протеолитических ферментов
Хроническая бактериальная инфекция
Кортикостероиды, НПВС
Необратимое повреждение легочной ткани
t
Трансплантация легких
Рис 41 91 Подходы к терапии заболеваний легких при MB.
ром начались разработки по генной терапии. К проблемам, связанным с генотера- пией, относятся низкий уровень экспрессии гена и ее преходящий характер, развитие иммунного ответа на белок вектора как антителами, так и фагоцитами, развитие как местных, так и системных воспалительных реакций [5, 31].
Восстановление функции белка МВТР (муковисцидозный трансмембранный регулятор). Терапевтическая стратегия, альтернативная генной терапии, заключается в выявлении веществ, способных стимулировать синтез, транспорт или функции неполноценного МВТР (рис. 4.1.9.1). В настоящее время исследуется ряд веществ: аминогликозидные антибиотики (при мутациях I типа), фенилбутират натрия, циклопентилксантин, гинестин (при мутациях II типа) и др. [32].
Гинестин - ингибитор тирозинкиназы, способен активировать секрецию хлора путем связывания со вторым нуклеотид- связывающим доменом МВТР-белка и, таким образом, держать хлорный канал открытым у больных с Р508сІеІ-мутацией [21].
Профилактика. В последнее десятилетие достигнут большой успех в области генетических исследований MB. Это очень важно не только в перспективе его генной терапии, но и в возможности первичной профилактики, то есть предупреждения рождения больного MB в перспективных и информативных семьях, что в настоящее время может быть гарантировано практически в 100% случаев. Эффективная дородовая ДНК-диагностика MB осуществляется в Москве, Санкт-Петербурге, Ростове-на-Дону, Томске, Уфе. Кроме того, безусловно, ДНК-обследование помогает в дифференциальной диагностике сложных форм MB, определении характера течения болезни и, наконец, возможности новых подходов к лечению с учетом ее этиологии и патогенеза [2, 5, 12].
Литература
1 Амелина Е Л, Черняк А В, Черняев А Л Муко- висцидоз определение продолжительности жизни Пульмонология 2001, (3) 61-4
2 Капранов Н И Шабалова Л А Каширская Н Ю и др Муковисцидоз (современные достижения и проблемы) Методические рекомендации М Медпрактика, 2001,76
3 Hodson М Е, Duncan М G Cystic Fibrosis - Arnold, a member of the Hodder Headline Group London, UK 2000, 477
4 Kerem В Kerem E The molecular basis for disease variability in cystic fibrosis Eur J Hum Genet 1996 4 65-73
5 Иващенко T Э, Баранов В С Биохимические и молекулярно-генетические основы патогенеза муковисцидоза СПб Интермедика, 2002, 256
6 Witt М Chronic pancreatitis and cystic fibrosis Gut 2003, (Suppl 2) 1131-41
7 Tsui L С The spectrum of cystic fibrosis mutation Trends Genet 1992, 8 392-8
8 Welsh M J, Smith A E Molecular mechanisms of CFTR chloride channel dysfunction in cystic fibrosis Cell 1993, 73 1252-4
9 Salvatore F, Scudiero D, Castaldo G Genotype- phenotype correlation in cystic fibrosis The role of modifier genes Am J Med Genet 2002 111 88-95
10 Ooering G, Knight R, Bellon G Immunology of cystic fibrosis In Cystic fibrosis Accuracy and cost of antibiotic susceptibility testing of mixed morphotypes of pseudomonas aeruginosa MEMorhn, GL Hedges, A L Smith, J L Burns, eds J Clin Microbiol 1994,32 1027-30
11 Smith J J, Travis S, Grenberg E P Cystic fibrosis airway epithelia fail to kill bacteria of abnormal surface Cell 1996, 85 220-36
12 Капранов H И Фармакотерапия при бронхоле- гочных поражениях у детей, больных муковисцидозом Руководство ло фармакотерапии в педиатрии и детской хирургии М Медпрактика, 2002,1(13) 187-201
13 Armstrong D S, Grimwood К, Cardm J В, et al Lower airway inflammation in infants and young children with cystic fibrosis Am J Respir Crit Care Med 1997,156 1197-204
14 Зубков MH, Самой ленко В А, Гугуцидзе E H, Чучалин А Г Микробиологические аспекты этиологии и антимикробной терапии бронхолегочной инфекции при муковисци- дозе у взрослых Пульмонология 2001, (3) 38-41
15 Ooering G, Conway SP, Heijerman HGM Hodson M E, et al Antibiotic therapy against Pseudomonas aeruginosa in cystic fibrosis a European consensus Eur Respir J 2000, 16 749-67
16 Hoiby N Microbiology of lung infections in cystic fibrosis patients Acta Paediatr Scand 1982, 301 33-54
17 Nguyen T Louie SG, Beringer PM Gill MA Potential role of macrolide antibiotics in the management of CF lung desease Curr Opin Pulm Med 2002,8(6) 521-8
18 Rosenstein В J, Zeitlin P L Cystic fibrosis Lancet 1998,351 277-82
19 Капранов H И Современные проблемы муковисцидоза Гастроэтерология Санкт Петербурга 2002 (4) 11-5
20 Smaasappel М, Stern М Littlewood J, et al Nutrition in patients with cystic fibrosis a European Consecsus J Cystic Fibrosis 2002 1 51-75
21 Каширская H Ю Состояние желудочно-кишечного тракта поджелудочной железы и гепато- билиарной системы у больных муковисцидозом Автореф дисс докт мед наук М 2001,45
22 Капустина Т Ю Изменения печени и их коррекция при муковисцидозе у детей на современном этапе Автореф дисс канд мед наук М, 2002, 22
23 Kelly D A Disease of the liver and biliary System in Children - Blackwell Science Ltd, Oxford, United Kingdom 1999,141-56
24 Сухов M H Лечение больных муковисцидозом с синдромом портальной гипертензии на фоне цирроза печени Автореф дисс канд мед наук М, 2002, 24
25 Louis D, Chazalette J P Cystic fibrosis and portal hypertension interest of partial splenectomy Eur J Pediatr Surg 1993, 3 22-4
26 Thalhammer G H, Eber E, Uranus E, et al Partial splenectomy in cystic fibrosis patients with hyper- splemsm Arch Dis Child 2003, 88 143-6
27 Лубская Т В Капранов Н И, Каширская Н Ю и др Клинический эффект длительного применения мапых доз макролидов в комплексном лечении муковисцидоза у детей Пульмонология 2001, (3) 41-5
28 Bowler S Clinical trial azithromycin in CF Pediatr Pulmonol 2000, 520 376
29 Equi A, Balfour-Lynn IM Bush A Rosenthal M Long term azitromycin in children with cystic fibrosis a randimised, placebo-controlled crossover tria Lancet 2002, 360 979-83
30 Симонова О И Кинезитерапия в комплексном лечении больных муковисцидозом Автореф дисс докт мед наук М, 2001,46
31 Ostedgaard L S, Zabner J, Vermeer D W, et al CFTR with a partially deleted R domain corrects the cystic fibrosis chloride transport defect in human airway epithelia in vitro and inmouse nasal mucosa in vivo Proc Natl Acad Sci USA 2002,99 3093-8
32 Koch С Early Infection and Progression of Cystic Fibrosis Lung Disease Pediatr Pulmonol 2002,34 232-6
4.2. Моногенные болезни, наследующиеся по аутосомно-доминантному типу
Общая характеристика доминантного типа наследования и аутосомно-доминантных болезней
Понятие «доминантности» и понимание того, что наследственные единицы передаются неизменными и не перемешиваются, относится к опытам Грегора Менделя Однако семьи с доминантным наследованием пороков развития или функциональных аномалий были известны и раньше Еще в 1833 г Cunier описана семья Nougaret, в которой в девяти поколениях было 134 больных куриной слепотой и все потомки происходили от Jean Nougaret, родившегося в 1637 г
|
|
|


