 |
Способы совершенствования хирургической обработки гнойной раны
|
|
|
|
Лечебный эффект хирургической обработки раны значительно возрастает если дополнительно произвести ее обработку пульсирующей струей антисептиков, лучами лазера, ультразвуком, вакуумную обработку.
ОБРАБОТКА ГНОЙНОЙ РАНЫ ПУЛЬСИРУЮЩЕЙ СТРУЕЙ АНТИСЕПТИКА
Попытки промывания ран большим количеством жидкости во время хирургической обработки делались давно, но не получили распространения из-за технического несовершенства и отсутствия объективных методов контроля, позволяющих определять степень эффективности процедуры. Разработка современной аппаратуры и количественной бактериологии позволила в значительной степени избавиться от этих недостатков и создать новый метод — обработку раны пульсирующей струей жидкости. Впервые он был разработан в эксперименте S. Bhaskar и соавт. (1971), A. Gross и соавт. (1973) и др.
В эксперименте установлено, что:
1) пульсирующая струя жидкости в 3—4 раза эффективнее удаляет из раны детрит и микроорганизмы, чем промывание под давлением, но без пульсации;
2) в результате обработки пульсирующей струей уменьшается обсемененность раны (оценка по конечному клиническому эффекту);
3) оптимальными параметрами работы аппарата являются: частота пульсаций — 900—1200 в минуту, давление струи жидкости на выходе — 70 psi (4,48 кг/см 2) (при этом расходуется 700 мл жидкости в минуту). Давление в пределах 50—120 psi (на выходе) не повреждает ткани раны (рис.6,7,8);
4)обработка пульсирующей струей значительно снижает радиоактивное загрязнение раны (Grower M., Bhaskar S., 1972).
Эффект обработки объясняется в основном механическим воздействием на рану: в фазе «давления» струя жидкости освобождает слабо фиксированные элементы, в том числе мелкие обрывки омертвевших тканей, мелкие инородные тела, свертки крови и микробные тела; в межпульсовой «декомпрессионной» фазе они удаляются из раны потоком жидкости. Благодаря завихрению струя перемещается по ране в виде «бегающего пятна» и обработка не занимает много времени (рис.9,10).
|
|
|
Данный способ рассматривается не как самостоятельный метод лечения, а как дополнение к хирургической обработке раны или совершенствование ее. Широко применяют обработку обширных гнойных ран пульсирующей струей и в процессе лечения — во время перевязок, при необходимости сочетая ее с этапной некрэктомией.

Рис.6. Аппарат Surgilav для обработки ран пульсирующей струей антисептика.


Рис.7. Переносной аппарат для обработки Рис.8. Передвижной аппарат для
ран пульсирующей струей антисептика. обработки ран пульсирующей струей.


Рис. 9,10. Обработка гнойной раны пульсирующей струей фурацилина.
Вакуумная обработка гнойной раны
Метод вакуумной обработки ран применяется давно, главным образом для лечения длительно не заживающих ран и трофических язв.
В последнее время вновь стали производить вакуумирование обширных загрязненных ран и открытых переломов для механической очистки ран от загрязнения. При вакуумной обработке наконечник плотно прижимают к стенкам раны и, перемещая его, производят отсасывание детрита, свободных и слабофиксированных участков тканей, инородных частиц и микрогематом (рис.11). При этом одновременно орошают рану раствором фурацилина или пульсирующей струей другой жидкости с целью удаления всех нежизнеспособных тканей из полости раны. Процедура занимает от 5 до 10 минут в зависимости от площади и степени загрязнения раны.
Механизм воздействия вакуумирования на ткани заключается в том, что под влиянием отрицательного давления все нежизнеспособные и слабо фиксированные частицы засасываются через раструб наконечника в отстойник вакуум-аппарата, в результате чего происходит очищение тканей и полости раны от гематомы, детрита и микробных тел. Кроме того, по мнению В. П. Охотского и И.Ф.Бялика (1980), вакуумирование улучшает кровообращение и лимфоток в ране, что благоприятствует ее заживлению.
|
|
|

Рис.11. Установка для вакуумной обработки ран(схема).
1- вакуумный насос; 2-вентель; 3-масляная ловушка; 4- регулятор давления; 5- предохранительный приемник; 6- приемник раневого отделяемого; 7- шкала уровня раневого отделяемого в приемнике; 8- вакуумметр; 9- соединительные трубки; 10- аспиратор.
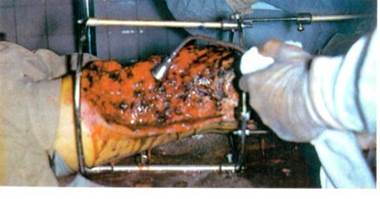
Рис.12. Вакуумирование раны после хирургической обработки.
По литературным данным, во время проведения сеанса вакуум-терапии происходит аспирация раневого отделяемого в количестве не более 8-10 мл (в среднем 5,8+1,2 мл). Причем, с каждым последующим сеансом оно стремительно уменьшается до ничтожно малой величины.
Примечательно, что в начале сеанса в полусферическую камеру поступает скудное гнойное отделяемое мутно-желтого цвета. Затем происходит аспирация прозрачного серозного экссудата желеобразной консистенции. В конце сеанса после снятия полусферической камеры с раны и удаления стержня всегда видно, что в раневой полости содержится в незначительном количестве именно такого характера биологический секрет. При изучении его рН установлена слабощелочная реакция экссудата. Рентгеногистовульнографические исследования позволяют выяснить природу этой жидкости и объяснить установленный уровень ее рН. Наиболее вероятным источником образования такого экссудата является жидкость, активно поступающая из межтканевого пространства.
Как известно, слабощелочная реакция среды раны является губительной для микроорганизмов. В связи с этим создание подобных условий в раневой полости с помощью вакуум-терапии является оптимально благоприятным. Следовательно, полное осушение раны после сеанса вакуумирования патогенетически не оправдано.
В период между сеансами, как показывает практика, в ране образуется скудное количество отделяемого, которое практически не депонируется в полости. Поэтому по окончании процедуры дополнительного дренирования раны не требуется (рис.12).
|
|
|
Таким образом, использование вакуум-терапии в рекомендуемых режимах ее проведения обеспечивает в течение сеанса воздействия активную элиминацию отделяемого из раны и создает в раневой полости благоприятную среду, антибактериальные свойства которой сохраняются в течение суток до следующего сеанса вакуумирования. Данное обстоятельство позволяет считать, что благодаря вакуум-терапии фактически с первых часов ее применения создаются условия для полноценного эффективно-адекватного контролируемого дренирования раны в течение всего периода лечения.
Обработка гнойной раны лучами лазера
Внедрение в хирургическую практику методов лазерного облучения побудило исследователей к их апробации при лечении гнойной раны. В нашей стране созданы лазерные хирургические установки с наполнением углекислым газом («Скальпель», «Разбор»).
Используя высокую энергетическую мощность СО2-лазеров, некоторые авторы применяют сфокусированный луч лазера в качестве «светового скальпеля» (Хромов Б. М., 1973; Вишневский А. А., 1973; Скобелкин О. К. и др., 1980; Aronoff В., 1983; BeJlina Т., 1983) (рис.13). Его преимуществами считают быстрое одномоментное удаление всех пораженных тканей при незначительной кровопотере благодаря эффекту фотокоагуляции, малую травматизацию тканей, стерилизующее действие на раневую поверхность, благоприятное течение послеоперационного периода.
Иссечение гнойного очага производят сфокусированным лучом лазера, дополняя вмешательство “выпариванием” раневой поверхности расфокусированным лучом. Время, затраченное на оперативное вмешательство и гемостаз, составляет при карбункулах 17- 22 мин, при абсцессах и флегмонах- 30-45 мин и возрастает при обширных флегмонах. Кровопотеря во время операции бывает обычной, как при работе со скальпелем или электроножом.
При длительно не заживающих ранах операцию производят расфокусированным лучом лазера на фоне подострого или хронического воспаления.
|
|
|
Установлено, что глубина воздействия лазером находится в прямой зависимости от экспозиции и легко дозируется, а уничтожение микрофлоры в ране достигается расфокусированным лучом. Особенно эффективен лазер в первую фазу раневого процесса (О.К.Скобелкин с соавт., 1984; В.К.Гостищев с соавт., 1991; Ю.В.Стручков с соавт., 1991; Р.А.Кулиев с соавт., 1992; А.И. Эфендиев с соавт., 1992; Р.С.Черская с соавт., 1994).
В.В.Волков с соавт, (1985) находит к тому же положительное действие лазера и в стимуляции механизмов контракции, что приходится на конец второй и на третью фазу заживления. Следовательно, данный способ воздействия целесообразно применять во все периоды раневого процесса.
Появились сообщения об использовании направленного потока энергии более высокой температуры - плазменной обработки раны (Е.И.Брехов с соавт.,1986).

Рис.13. Плазменный скальпель.
Обработка гнойной раны ультразвуком
Кроме фармакологических средств, применяемых при лечении гнойных ран, большая роль отводится ряду физических факторов, оказывающих существенное влияние на течение раневого процесса. Одним из таких мощных средств является ультразвуковая обработка ран, стимулирующая одну из первых фаз раневого процесса - стадию очищения раневого ложа. Ультразвук находит все более широкое применение в клинической практике для обработки гнойных ран.
Однако в настоящее время не существует единого мнения о механизме его терапевтического действия. В настоящее время разрабатываются два способа ультразвуковой обработки ран: «ультразвуковым ножом» и озвучиванием гнойной раны (ультразвуковая кавитация), полость которой заполняется антибактериальным раствором. Сущность метода состоит во введении в полость гнойной раны раствора антибиотика или антисептика, который подвергается воздействию ультразвуковых колебаний с помощью аппарата УРСК-7Н (разработан в МВТУ им. Н. Э. Баумана) (рис.14) и волноводов с диаметром излучающей поверхности от 4 до 8 мм. Время обработки зависит от размеров раны и колеблется от 3 до 10 мин. В процессе ее излучающая поверхность волновода (торец) проходит по всей поверхности раны, не касаясь ее тканей.
Механизм действия ультразвука на биологические ткани сложен и не до конца изучен. Отмечают его бактерицидный, некролитический и биостимулирующий эффект. Считается, что основой действия НЧУЗ являются тепловые и нетепловые воздействия. Тепловой эффект основывается на поглощении энергии ультразвуковой волны тканями. При этом повышается местная температура, способствуя усилению кровотока и активации обменных процессов. Однако при дальнейшем локальном воздействии возможно проявление термических поражений. Среди нетепловых эффектов НЧУЗ в основном выделяют, кавитацию, акустические течения, давление и излучение.
|
|
|
Экспериментальное и клиническое применение ультразвука выявило его противовоспалительное, рассасывающее, десенсибилизирующее действие. В качестве решающего фактора, обуславливающего гибель бактерий и вирусов в ультразвуковом поле, исследователи называют кавитацию. Наибольшее количество биологических эффектов ультразвука связывают с процессом кавитации, характеризующимся образованием и распадом микроскопических пузырьков в озвучиваемой жидкости. Результатом этого является активация окислительно-восстановительных процессов в тканях, распад и синтез органических соединений. Образующееся при кавитации ультрафиолетовое излучение является пусковым моментом фотохимических реакций, а многочисленные свободные радикалы H+ и ОН- активно вступают в окислительно-восстановительные реакции. Возникающее при использовании НЧУЗ переменное акустическое давление способствует диффузии вглубь ткани лекарственных веществ, а изменении концентрации ионов вокруг клетки определяет их усиленное проникновение внутрь ее, усиливает обмен веществ и повышает регенеративные функции тканей.
В ответ на ультразвуковое воздействие происходит дегрануляция тучных клеток, освобождение серотонина из тканей, повышение активности простагландинов. Мощное бактерицидное действие НЧУЗ связывают как с эффектом кавитации, так и с повреждающим действием ультразвуковых волн на клеточную стенку микроорганизмов. При захлопывании кавитационного пузырька вследствие внезапной остановки всей массы жидкости, участвующей в движении в точке схлопывания, генерируется импульс давления, который может вызвать механическое повреждение оболочки бактериальной клетки, «расшатывание» внутриклеточных молекулярных комплексов, нарушение окислительно-восстановительных процессов клетки. Эффективное воздействие кавитациоиного пузырька на оболочку микроорганизма происходит только при условии, когда микроорганизм находится в непосредственной близости от захлопывающегося пузырька.
Становится очевидным, почему бактерицидный эффект НЧУЗ растет при насыщении озвученной жидкости тем или иным газом, который снижает порог кавитации среды (Николаев Г.А., Лощилов В.И., 1980; Лощилов В.И., Амброзевич Е.Г., 1987). При озвучивании объекта за счет снижения вязкости многих гелей и золей в ультразвуковом поле происходит усиление процессов диффузии в ране, которые в обычных условиях протекают медленно. При этом УЗ способствует проникновению жидкого лекарственного препарата в ткани на большую глубину через межклеточные капиллярные промежутки, заполненные жидким коллоидным веществом: в кость на 2-3 мм, мягкие ткани - на 1,5-2 см, создавая там депо препарата. Результатом ультразвуковой обработки является гибель микрофлоры или изменение ее культуральных свойств.
В слое лекарственного вещества при озвучивании развивается процесс массообмена и массопереноса, что, помимо внедрения лекарственных веществ в ткани организма, приводит к очистке раневой поверхности от гноя, детрита, фибрина. Кроме того, воздействие НЧУЗ потенцирует действие антибактериальных препаратов путем дезинтеграции клеточных мембран микробов. Имеются также сведения о местном увеличении под влиянием ультразвука фагоцитарной активности нейтрофилов, стимуляции клеточного и гуморального иммунитета.

Рис.14. Аппарат для ультразвуковой обработки ран УРСК-7Н.
В.И.Кузнецов и соавт. (1986) показали, что ультразвуковые колебания низкой и средней частоты по-разному действуют на течение раневого процесса.
Низкочастотный ультразвук ускоряет очищение раны за счет кавитационного разрушения клеточных элементов отделяемого и выделения лизосомальных энзимов, хемотаксических факторов, бактерицидных катионных белков. Среднечастотный ультразвук стимулирует вторую фазу раневого процесса. Наиболее эффективно сочетание ультразвука низкой и средней частоты, что подтверждено и клиническими итогами лечения.
При ультразвуковой обработке создается возможность целенаправленного воздействия на раневую инфекцию путем подбора препарата по чувствительности микрофлоры, использования различных антисептиков и протеолитических ферментов (рис.15).

Рис.15. Обработка гнойной раны ультразвуком в процессе операции.
Многие авторы отмечают, что если ультразвук не приводит к гибели бактериальной клетки, то он изменяет ее функциональное состояние, в которой под его воздействием происходят тонкие биохимические и физико-коллоидные сдвиги, сопровождающиеся повышением чувствительности к антибиотикам и другим факторам внешней среды, снижением вирулентных свойств при сохранении иммуногенных особенностей озвученных микроорганизмов. Выделенная из гнойных ран флора после ультразвуковой обработки дает атипичный рост колоний, изменяет свои морфологические и культуральные свойства (Чаплинский В.В. и соавт., 1980; Богдасаров В.В., 1982; Гераськии В.И. и соавт., 1982; Оганесян М.А., 1982, 1986).
Под воздействием ультразвука антибиотики и другие лекарственные средства из озвучиваемой среды проникают на значительную глубину в предлежащие ткани.
Однако говоря об улучшении пенетрации лекарственных веществ, следует указать на то, что вместе с ними, к сожалению, из раны в ткани паравульнарной зоны перемещаются и распространяются частицы патологического содержимого и микроорганизмы с токсинами. При этом фонофорез антибиотиков не предотвращает микробную инвазию (П.И.Младенцев с соавт., 1986; В.Ф.Горяинов с соавт.,1986). Все это вызывает усиление интоксикации, в ряде случаев сопровождается выраженной иммуносупрессией, что может отрицательно сказываться на развитии гнойного процесса с синдромом системной воспалительной реакции. С другой стороны при использовании ультразвука имеет место ухудшение локальных микроциркуляторно-перфузионных показателей, негативно отражаясь на состоянии естественной резистентности и регенерации.
Следует еще раз подчеркнуть, что описанные методы следует рассматривать как дополнение к хирургической обработке раны, но не как самостоятельный метод лечения. Каждый из методов позволяет очистить рану от некротизированных тканей и микробов.
КРИОХИРУРГИЯ ГНОЙНОЙ РАНЫ
Метод криовоздействия на гнойную рану относительно недавно начали изучать в эксперименте (Панков Е. Я. и др., 1977; Пушкарь Н. С. и др., 1977), и лишь в настоящее время он получил достаточное клинико-экспериментальное обоснование. Б. П. Сандомирский и В. П. Чеканов (1986), В. И. Лупальцов и соавт. (1986) показали, что в ранах, подвергнутых низкотемпературному воздействию, количество микробов становится ниже критического уровня, уменьшается ацидоз раневого содержимого, повышается бактерицидная и фагоцитарная активность лейкоцитов. Вследствие этого ускоряются очищение раны и регенерация, сокращаются сроки лечения.
ЭНЗИМОТЕРАПИЯ ГНОЙНОЙ РАНЫ
Важное место в очищении раны отводится активизации ферментативных процессов в тканях с помощью протеолитических энзимов. Быстрее расщепляя белки, энзимы противостоят гидратации тканей раны и таким образом уменьшают продолжительность экссудации. Важно и то, что использование протеаз потенцирует действие антибиотиков и одновременно снижает резистентность микроорганизмов к ним (В.К.Гостищев с соавт.,1980; Ю.В.Стручков,1982; Н.Я.Кабанов, Е.Ю.Осинцев,1991; П.И.Толстых с соавт., 1991).
Ввиду того что детальное строение молекул ферментов еще не ясно, в основу их подразделения положен функциональный принцип, основанный на определении способности ферментов принимать участие в химических реакциях определенного типа. Исходя из этого ферменты разделяют на 6 главных групп, или классов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы.
Такое деление ферментов одобрено Ассамблеей Международного биохимического союза на заседании V Международного биохимического конгресса, состоявшегося в августе 1961 г. в Москве.
Ферменты каждого из этих классов оказывают катализирующее действие на определенные сложные биохимические превращения белковых веществ как в живом организме, так и вне его.
Ферменты из класса оксидоредуктаз катализируют реакции окисления и восстановления, трансферазы — реакции переноса химических групп атомов, гидролазы — реакции гидролиза, лиазы — реакции отщепления химических групп с оставлением двойной связи и пр.
Каждый из классов делится на подклассы и затем на подподклассы.
В клинической практике наиболее широко применяются ферменты, способствующие осуществлению реакции расщепления и синтеза. Это та группа ферментов, которая катализирует расщепление органических соединений на более простые, а также синтез соединений. К ним относят гидролазы, катализирующие гидролитическое расщепление органических соединений и их синтез. Среди гидролаз выделяют следующие подклассы:
1)ферменты, катализирующие гидролитическое расщепление синтез белков и пептидов по месту пептидной связи — протеиназы, пептидазы (всего 69 ферментов — здесь и далее по М. Диксону и Э. Уэббу (Dixon M., Webb E. С, 1961));
2)ферменты, гидролизующие амины и т. п., — дезаминазы;
3)ферменты, гидролизующие сложноэфирные связи, — эстеразы, фосфодиэстеразы;
4)ферменты, гидролизующие гликозидные связи, — гликозидазы;
5)ферменты, гидролизующие связи кислотных ангидридов — ангидразы;
6)ферменты, гидролизующие другие связи.
1. К первой группе ферментов класса гидролаз относятся ферменты двух типов: 1) протеиназы, осуществляющие гидролитическое расщепление белков внутри молекулы с образованием менее сложных белков — пептидов — с более низким молекулярным весом (такие ферменты называются эндопептидазами, или эндопротеиназами) и 2) пептидазы — ферменты, расщепляющие концевые фрагменты белковой молекулы с образованием аминокислот. Подобные ферменты называются экзопротеиназами, или экзопептидазами.
2. Ферменты подкласса дезаминаз действуют на азотистые основания (адеин и гуанин), а также на аминокислоты (мочевина, глютамин и др.). Под влиянием гидролизующего действия ферментов отщепляется свободный аммиак.
3. Эстеразы включают ферменты липазы, расщепляющие сложные эфиры, образованные органическими кислотами и спиртами.
В эту же группу эстераз входит несколько типов фосфатаз, ускоряющих процесс расщепления сложных эфиров, образованных спиртом и фосфорной кислотой или фосфорной кислотой и двумя спиртами (фосфодиэстеразы). К числу фосфодиэстераз относятся ферменты, расщепляющие рибонуклеиновую кислоту и другие соединения.
4. Гликозидазы — ферменты, расщепляющие гликозидные связи, образованные двумя спиртовыми группами. К группе гликозидаз относятся такие ферменты, как гиалуронидаза. лизоцим и др.
5. Ангидразы (анираза и др.) отщепляют пирофосфат от аденозинтрифосфорной кислоты.
6. К группе ферментов, гидролизующих другие связи, относятся катализаторы, которые разрывают связи между атомами угле рода и серы, атомами углерода и углерода (метилцистеиназа, триптофаназа и др.).
Большое разнообразие ферментов, катализирующих один и тот же тип реакции, Джексон и Уэбб объясняют специфичностью их по отношению к другим частям молекулы субстрата помимо той группы, на которую непосредственно действует фермент.
В настоящее время для лечения гнойно-воспалительных и тромботических заболеваний применяются протеолитические ферменты (трипсин, химотрипсин, плазмин, папаин и др.), стрептокиназа, активирующая плазминоген, ферменты, деполяризирующие ДНК (дезоксирибонуклеазы, сокращенно ДН-азы, или дорназы) и РНК (рибонуклеаза, сокращенно РН-аза); гиалуронидаза. расщепляющая мукополисахариды. Последний препарат в основном применяется для лечения рубцовых процессов, ускорения всасывания вводимых препаратов.
Ферменты, используемые в хирургической клинике, могут быть получены из поджелудочной железы (трипсин, химотрипсин, панкреатическая рибонуклеаза и дезоксирнбонуклеаза), из растительных продуктов (бромелаин из ананасов, папаин, или папаза, из плодов и листьев дынного дерева Carica papaja и др.), из бактериальных культур (стрептокиназа и стрептодорназа из гемолитического стрептококка, коллагеназа из Cl. histolyticum, а-амилаза из В. subtilis и др.).
Ферменты, по-видимому, не оказывают непосредственного антибактериального действия, но, благодаря способности расщеплять выделяемую антибиотикорезистентными бактериями пенициллиназу, а также некоторые бактериальные токсины, несомненно, усиливают противомикробное действие антибиотиков, что особенно важно при устойчивой флоре.
Одним из существенных недостатков применения протеаз является кратковременность их действия вследствие аутолиза, в связи с чем предлагается использовать протеолитические ферменты, иммобилизированные на матрице (П.И.Толстых, 1986; С.П.Глянцев, 1987; СП.Глянцев с соавт.,1991; А.А.Адамян, СП.Глянцев, 1992).
ДРЕНИРОВАНИЕ ГНОЙНОЙ РАНЫ
Многовековой опыт хирургии не ставит под сомнение необходимость дренирования гнойной раны. Показания к дренированию определяются необходимостью удаления из полости гнойной раны микробов, отделяемого и продуктов тканевого распада. Полноценное дренирование, обеспечивая достаточный отток раневого экссудата, создает наилучшие условия для скорейшего отторжения погибших тканей и перехода процесса заживления в фазу регенерации. Противопоказаний к дренированию раны практически нет. Прогресс гнойной хирургии и антибактериальной терапии выявил и еще важнейшее достоинство дренирования - возможность целенаправленной, а не опосредованной борьбы с раневой инфекцией.
|
|
|


