 |
4.1.1 Многовариантное задание № 10 «Электрические свойства молекул»
|
|
|
|
4. 1. 1 Многовариантное задание № 10 «Электрические свойства молекул»
Рассчитать дипольный момент и эффективный радиус молекулы С на основании экспериментальных значений молярной поляризуемости при заданной температуре t (таблица 4. 1). При расчете пренебречь величиной атомной составляющей поляризуемости, молярную рефракцию вычислить по правилу аддитивности.
4. 1. 2. Контрольные вопросы
1. Какие изменения происходят в неполярной молекуле при ее помещении в постоянное электрическое поле?
2. Чем отличается поляризация полярной молекулы от поляризации неполярной молекулы при ее помещении в постоянное электрическое поле?
3. Из каких экспериментальных данных можно рассчитать величину молярной поляризуемости молекулы?
4. В чем заключается поляризации молекул в высокочастотном переменном электрическом поле? Как называется молярная поляризуемость молекулы в высокочастотном электрическом поле?
5. Как, используя электрические свойства молекулы, оценить ее ориентировочный радиус?
6. Какое свойство молярной рефракции используется для определения структурной формулы молекулы? Как определить структурную формулу молекулы?
7. Как определить дипольный момент молекулы, используя уравнение Дебая?
8. Как определить количественный состав раствора, используя удельную рефракцию раствора? Какие экспериментальные данные для этого необходимы?
Таблица 4. 1 - Варианты заданий
|
Вариант |
Молекула С | Подвариант | |||||||||||
| t, oC | Pm× 106, м3/моль | t, oC | Pm× 106, м3/моль | t, oC | Pm× 106, м3/моль | t, oC | Pm× 106, м3/моль | t, oC | Pm× 106, м3/моль | t, oC | Pm× 106, м3/моль | ||
| Бромбензол | 72. 82 | 72. 00 | 71. 15 | 70. 38 | 69. 63 | 68. 92 | |||||||
| Хлорбензол | 74. 16 | 73. 17 | 72. 23 | 74. 68 | 71. 33 | 68. 85 | |||||||
| Фенол | 53. 96 | 53. 51 | 52. 97 | 52. 71 | 52. 45 | 52. 20 | |||||||
| Диэтиловый эфир | 45. 83 | 45. 18 | 44. 57 | 44. 27 | 43. 71 | 43. 43 | |||||||
| Дихлорметан | 66. 62 | 65. 84 | 64. 36 | 62. 97 | 61. 65 | 59. 23 | |||||||
| Диброметан | 88. 79 | 85. 04 | 83. 31 | 81. 68 | 78. 66 | 75. 93 | |||||||
| Диметиловый эфир | 52. 27 | 49. 24 | 47. 13 | 48. 15 | 45. 26 | 44. 39 | |||||||
| Ацетальдегид | 129. 11 | 123. 13 | 117. 72 | 115. 20 | 110. 52 | 108. 33 | |||||||
| Ацетонитрил | 274. 27 | 270. 65 | 263. 70 | 250. 85 | 233. 85 | 223. 74 | |||||||
| Хлорэтан | 97. 71 | 91. 41 | 87. 03 | 85. 03 | 81. 34 | 78. 03 | |||||||
| Бромэтан | 90. 66 | 86. 72 | 84. 91 | 81. 57 | 78. 55 | 75. 81 | |||||||
| Дихлорэтилен | 162. 23 | 155. 03 | 148. 52 | 142. 62 | 158. 54 | 145. 50 | |||||||
| Этанол | 61. 46 | 60. 12 | 58. 86 | 56. 52 | 53. 43 | 49. 16 | |||||||
| Пропанол | 61. 28 | 59. 05 | 56. 11 | 54. 37 | 52. 04 | 51. 33 | |||||||
| Этиленгликоль | 76. 56 | 75. 91 | 75. 27 | 74. 95 | 74. 04 | 72. 86 | |||||||
| Нитробензол | 249. 91 | 247. 61 | 245. 35 | 240. 97 | 236. 77 | 232. 72 | |||||||
| Хлорэтилен | 54. 78 | 53. 61 | 51. 47 | 49. 56 | 47. 85 | 46. 30 | |||||||
| Бромэтилен | 56. 07 | 54. 95 | 52. 90 | 51. 07 | 49. 42 | 47. 93 | |||||||
| Формальдегид | 87. 56 | 79. 02 | 75. 84 | 74. 35 | 72. 92 | 68. 98 | |||||||
| Бромметан | 74. 74 | 72. 93 | 71. 23 | 69. 63 | 68. 11 | 66. 67 | |||||||
| Метилацетат | 71. 64 | 70. 07 | 68. 59 | 65. 86 | 63. 41 | 60. 17 | |||||||
| Метанол | 60. 18 | 57. 97 | 56. 61 | 55. 31 | 59. 42 | 54. 09 | |||||||
| Этилацетат | 78. 67 | 77. 12 | 75. 65 | 74. 26 | 72. 91 | 71. 68 | |||||||
| Иодэтилен | 53. 58 | 52. 69 | 51. 05 | 49. 59 | 48. 27 | 47. 09 | |||||||
| Метиламин | 45. 71 | 42. 96 | 41. 06 | 40. 18 | 39. 36 | 38. 58 | |||||||
| Диметиламин | 36. 21 | 34. 57 | 33. 43 | 32. 91 | 32. 42 | 31. 95 | |||||||
4. 2 Оптические методы изучения строения молекул. Молекулярные спектры
|
|
|
4. 2. 1 Общая характеристика молекулярных спектров
|
|
|
Спектром называется последовательность квантов энергии электромагнитного излучения, поглощенных, выделившихся, рассеянных или отраженных веществом при переходах атомов и молекул из одних энергетических состояний в другие.
В зависимости от характера взаимодействия света с веществом спектры можно разделить на спектры поглощения (абсорбционные); испускания (эмиссионные); рассеяния и отражения.
По изучаемым объектам оптическая спектроскопия, т. е. спектроскопия в области длин волн 10-3÷ 10-8м подразделяется на атомную и молекулярную.
Атомный спектр представляет собой последовательность линий, положение которых определяется энергией перехода электронов с одних уровней на другие.
Энергию атома можно представить как сумму кинетической энергии поступательного движения  и электронной энергии
и электронной энергии  :
:
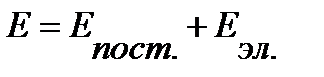 . .
| (4. 10) |
Последняя составляющая квантуется и, следовательно, отражается в спектрах. Величина кванта  связана с положением линии в спектре:
связана с положением линии в спектре:
 , ,
| (4. 11) |
где  - частота,
- частота,  - длина волны,
- длина волны, 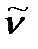 - волновое число,
- волновое число,  - скорость света,
- скорость света,  - постоянная Планка.
- постоянная Планка.
Так как энергия электрона в атоме обратно пропорциональна квадрату главного квантового числа  , то для
, то для 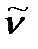 линии в атомном спектре можно записать уравнение:
линии в атомном спектре можно записать уравнение:
 . .
| (4. 12) |
Здесь  - энергии электрона на более высоком и более низком уровнях;
- энергии электрона на более высоком и более низком уровнях;  - постоянная Ридберга;
- постоянная Ридберга;  - спектральные термы, выраженные в единицах измерения волновых чисел (м-1, см-1).
- спектральные термы, выраженные в единицах измерения волновых чисел (м-1, см-1).
Все линии атомного спектра сходятся в коротковолновой области к пределу, определенному энергией ионизации атома, после которого идет сплошной спектр.
Энергию молекулы в первом приближении можно рассмотреть как сумму поступательной, вращательной, колебательной и электронной энергий:
 . .
| (4. 13) |
Если не рассматривать поступательную составляющую энергии, которая не отражается в спектре, то вклады отдельных составляющих сильно отличаются по величине:
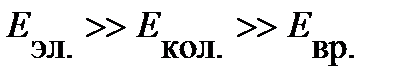
| (4. 14) |
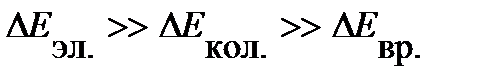
| (4. 15) |
.
Для большинства молекул такое условие выполняется. Например, для Н2 при 291К отдельные составляющие полной энергии различаются на порядок и более:
|
|
|
 = 309, 5 кДж/моль,
= 309, 5 кДж/моль,
 = 25, 9 кДж/моль,
= 25, 9 кДж/моль,
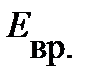 = 2, 5 кДж/моль,
= 2, 5 кДж/моль,
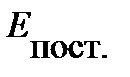 = 3, 8 кДж/моль.
= 3, 8 кДж/моль.
Значения энергии квантов в различных областях спектра сопоставлены в таблице 4. 2.
Таблица 4. 2 - Энергия поглощенных квантов  различных областей оптического спектра молекул
различных областей оптического спектра молекул
| Область спектра |  , кДж/моль , кДж/моль
| Молекулярные процессы – причина поглощения |
| микроволновая | 0, 0012-0, 12 | вращение молекул |
| дальняя ИК | 0, 12-2, 4 | |
| средняя ИК | 2, 4-60 | колебания ядер |
| ближняя ИК | 60-155 | |
| видимая | 155-300 | переходы валентных электронов |
| ближний УФ | 300-598 | |
| дальний УФ | 598-12000 |
Понятия «колебания ядер» и «вращение молекул» являются условными. В действительности такие виды движения лишь очень приближенно передают представления о распределении ядер в пространстве, которое носит такой же вероятностный характер, что и распределение электронов.
Схематичная система уровней энергии в случае двухатомной молекулы представлена на рисунке 4. 1.
Переходы между вращательными уровнями энергии приводит к появлению вращательных спектров в дальней ИК и микроволновой областях. Переходы между колебательными уровнями в пределах одного электронного уровня дают колебательно-вращательные спектры в ближней ИК области, поскольку изменение колебательного квантового числа  неминуемо влечет за собой изменение и вращательного квантового числа
неминуемо влечет за собой изменение и вращательного квантового числа  . Наконец, переходы между электронными уровнями вызывают появление в видимой и УФ областях электронно-колебательно-вращательных спектров.
. Наконец, переходы между электронными уровнями вызывают появление в видимой и УФ областях электронно-колебательно-вращательных спектров.
В общем случае число переходов может быть очень велико, но на самом деле в спектрах проявляются далеко не все. Количество переходов ограничено правилами отбора.
Молекулярные спектры дают богатую информацию. Они могут быть использованы:
- для идентификации веществ в качественном анализе, т. к. каждое вещество имеет свой собственный только ему присущий спектр;
- для количественного анализа;
- для структурно-группового анализа, поскольку определенные группы, такие, например, как > С=О, _NH2, _OH и др. дают в спектрах характеристические полосы;
|
|
|
- для определения энергетических состояний молекул и молекулярных характеристик (межъядерное расстояние, момент инерции, собственные частоты колебаний, энергии диссоциации); комплексное изучение молекулярных спектров позволяет сделать выводы о пространственном строении молекул;
- в кинетических исследованиях, в том числе для изучения очень быстрых реакций.

 - энергии электронных уровней;
- энергии электронных уровней;
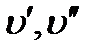 - энергии колебательных уровней;
- энергии колебательных уровней;
 - энергии вращательных уровней
- энергии вращательных уровней
Рисунок 4. 1 – Схематичное расположение уровней энергии двухатомной молекулы
|
|
|


