 |
4.2.4 Многовариантное задание № 11 «Вращательные спектры двухатомных молекул»
|
|
|
|
Решение
В приближении модели жесткого ротатора в соответствии с уравнением (4. 45) определяем вращательную постоянную:
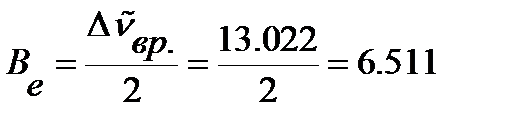 см-1.
см-1.
Момент инерции молекулы вычисляем из значения вращательной постоянной по уравнению (4. 46):
 кг . м2.
кг . м2.
Для определения равновесного межъядерного расстояния используем уравнение (4. 47), учитывая, что массы ядер водорода  и йода
и йода 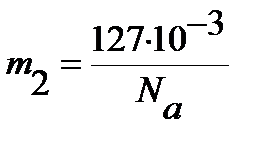 выражены в кг:
выражены в кг:
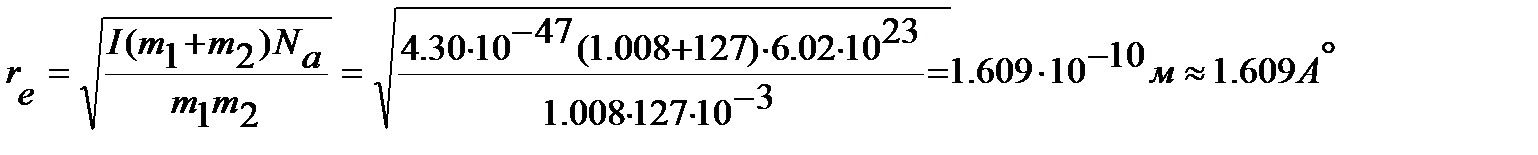
Пример. В дальней ИК-области спектра 1H35Cl обнаружены линии, волновые числа которых:
| N линии | |||||||
 , см-1 , см-1
| 85. 384 | 106. 730 | 128. 076 | 149. 422 | 170. 768 | 192. 114 | 213. 466 |
Определите усредненные значения момента инерции и межъядерного расстояния молекулы. Отнесите наблюдаемые линии в спектре к вращательным переходам.
Решение
Согласно модели жесткого ротатора разность волновых чисел  соседних линий вращательного спектра постоянна и равна 2
соседних линий вращательного спектра постоянна и равна 2  . Определим вращательную постоянную по среднему значению расстояний между соседними линиями в спектре:
. Определим вращательную постоянную по среднему значению расстояний между соседними линиями в спектре:
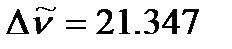 см-1,
см-1,
 см-1
см-1
Находим момент инерции молекулы (уравнение (4. 46)):
 кг·м2
кг·м2
Рассчитываем равновесное межъядерное расстояние (уравнение (4. 47)), принимая во внимание, что массы ядер водорода  и хлора
и хлора  (выражены в кг):
(выражены в кг):

По уравнению (4. 43) оцениваем положение линий во вращательном спектре 1H35Cl:

…

 и т. д.
и т. д.
Соотносим рассчитанные значения волновых чисел линий с экспериментальными. Получается, что наблюдаемые во вращательном спектре 1H35Cl линии соответствуют переходам:
| N линии | |||||||
 , см-1 , см-1
| 85. 384 | 106. 730 | 128. 076 | 149. 422 | 170. 768 | 192. 114 | 213. 466 |

| 3  4 4
| 4  5 5
| 5  6 6
| 6  7 7
| 7  8 8
| 8  9 9
| 9  10 10
|
Пример. Определите величину и направление изотопного сдвига линии поглощения, отвечающей переходу с  энергетический уровень, во вращательном спектре молекулы 1H35Cl при замещении атома хлора на изотоп 37Cl. Межъядерное расстояние в молекулах 1H35Cl и 1H37Cl считать одинаковым.
энергетический уровень, во вращательном спектре молекулы 1H35Cl при замещении атома хлора на изотоп 37Cl. Межъядерное расстояние в молекулах 1H35Cl и 1H37Cl считать одинаковым.
|
|
|
Решение
Для определения величины изотопного сдвига линии, отвечающей переходу  , рассчитываем приведенную массу
, рассчитываем приведенную массу  молекулы 1H37Cl с учетом изменения атомной массы 37Cl:
молекулы 1H37Cl с учетом изменения атомной массы 37Cl:
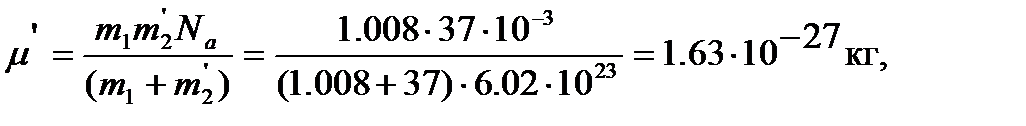
далее вычисляем момент инерции  , вращательную постоянную
, вращательную постоянную  и положение линии
и положение линии  в спектре молекулы 1H37Cl и величину изотопного сдвига по уравнениям (4. 35), (4. 39), (4. 43) и (4. 50), соответственно.
в спектре молекулы 1H37Cl и величину изотопного сдвига по уравнениям (4. 35), (4. 39), (4. 43) и (4. 50), соответственно.
Иначе изотопный сдвиг можно оценить из отношения волновых чисел линий, отвечающих одному и тому же переходу в молекулах, (межъядерное расстояние считаем постоянным) и далее положение линии в спектре, используя уравнение (4. 51).
Для молекул 1H35Cl и 1H37Cl отношение волновых чисел заданного перехода равно:

Для определения волнового числа линии изотопозамещенной молекулы подставляем найденное в предыдущем примере значение волнового числа перехода j → j+1 (3→ 4):
 .
.
Делаем вывод: изотопный сдвиг в низкочастотную или длинноволновую область составляет
85. 384 - 83. 049 = 2. 335 см-1.
Пример. Рассчитайте волновое число и длину волны наиболее интенсивной спектральной линии вращательного спектра молекулы 1H35Cl. Соотнесите линию с соответствующим вращательным переходом.
Решение
Наиболее интенсивная линия во вращательном спектре молекулы связана с максимальной относительной заселенностью вращательного уровня энергии.
Подстановка найденного в предыдущем примере значения вращательной постоянной для 1H35Cl (  см-1) в уравнение (4. 54) позволяет вычислить номер этого уровня энергии:
см-1) в уравнение (4. 54) позволяет вычислить номер этого уровня энергии:
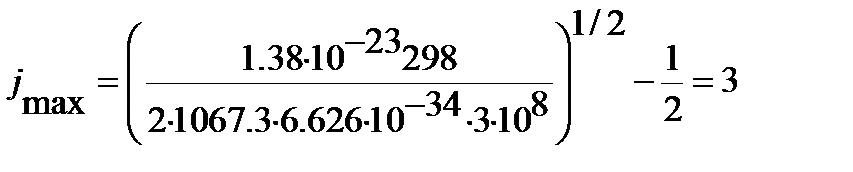 .
.
Волновое число вращательного перехода с этого уровня рассчитываем по уравнению (4. 43):
 ,
,
Длину волны перехода находим из преобразованного относительно  уравнения (4. 11):
уравнения (4. 11):
|
|
|
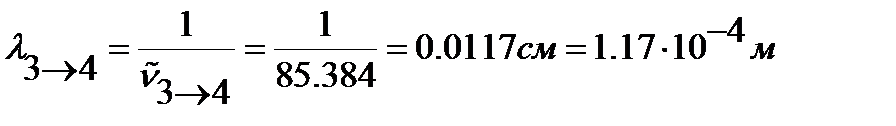 .
.
4. 2. 4 Многовариантное задание № 11 «Вращательные спектры двухатомных молекул»
1. Напишите квантово-механическое уравнение для расчета энергии вращательного движения двухатомной молекулы как жесткого ротатора.
2. Выведите уравнение для расчета изменения энергии вращения двухатомной молекулы как жесткого ротатора при переходе ее на соседний, более высокий квантовый уровень  .
.
3. Выведите уравнение зависимости волнового числа вращательных линий в спектре поглощения двухатомной молекулы от вращательного квантового числа.
4. Выведите уравнение для расчета разности волновых чисел соседних линий во вращательном спектре поглощения двухатомной молекулы.
5. Рассчитайте вращательную постоянную  (в см-1 и м-1) двухатомной молекулы A по волновым числам двух соседних линий в длинноволновой инфракрасной области вращательного спектра поглощения молекулы (см. таблицу 4. 3).
(в см-1 и м-1) двухатомной молекулы A по волновым числам двух соседних линий в длинноволновой инфракрасной области вращательного спектра поглощения молекулы (см. таблицу 4. 3).
6. Определите энергию вращения молекулы A на первых пяти квантовых вращательных уровнях (Дж).
7. Вычертите схематически энергетические уровни вращательного движения двухатомной молекулы как жесткого ротатора.
8. Нанесите пунктиром на эту схему вращательные квантовые уровни молекулы, не являющейся жестким ротатором.
9. Выведите уравнение для вычисления равновесного межъядерного расстояния на основании разности волновых чисел соседних линий во вращательном спектре поглощения.
10. Определите момент инерции  (кг. м2) двухатомной молекулы A.
(кг. м2) двухатомной молекулы A.
11. Рассчитайте приведенную массу  (кг) молекулы A.
(кг) молекулы A.
12. Вычислите равновесное межъядерное расстояние 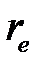 (
(  ) молекулы A. Сопоставьте полученное значение со справочными данными.
) молекулы A. Сопоставьте полученное значение со справочными данными.
13. Отнесите наблюдаемые линии во вращательном спектре молекулы A к вращательным переходам.
14. Рассчитайте волновое число спектральной линии, отвечающей вращательному переходу с уровня j для молекулы A (см. таблицу 4. 3).
15. Вычислите приведенную массу 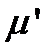 (кг) изотопозамещенной молекулы B.
(кг) изотопозамещенной молекулы B.
16. Рассчитайте волновое число спектральной линии, связанной с вращательным переходом с уровня j для молекулы B (см. таблицу 4. 3). Межъядерные расстояния в молекулах A и B считать равными.
17. Определите величину и направление изотопного сдвига во вращательных спектрах молекул A и B для спектральной линии, отвечающей переходу с вращательного уровня j.
|
|
|
18. Объясните причину немонотонного изменения интенсивности линий поглощения по мере увеличения энергии вращения молекулы
19. Определите квантовое число вращательного уровня, отвечающего наибольшей относительной заселенности. Рассчитайте длины волн наиболее интенсивных спектральных линий вращательных спектров молекул A и B.
Таблица 4. 3 – Варианты заданий
| Вариант | Молекула A | Под вариант |
| j | Молекула B | |
| LiH | 60. 12 | 75. 15 | Li2H | |||
| 180. 36 | 195. 39 | 8LiH | ||||
| 195. 39 | 210. 42 | 6Li3H | ||||
| 105. 21 | 120. 24 | Li3H | ||||
| 120. 24 | 135. 27 | 6LiH | ||||
| 90. 18 | 105. 21 | 6Li2H | ||||
| BCl | 4. 104 | 5. 472 | B37Cl | |||
| 8. 208 | 9. 576 | 10BCl | ||||
| 9. 576 | 10. 944 | B37Cl | ||||
| 10. 944 | 12. 312 | 10B37Cl | ||||
| 12. 312 | 13. 68 | 10BCl | ||||
| 17. 784 | 19. 152 | B37Cl | ||||
| BeH | 103. 15 | 123. 78 | Be2H | |||
| 82. 52 | 103. 15 | Be3H | ||||
| 226. 93 | 247. 56 | 5BeH | ||||
| 247. 56 | 268. 19 | 11BeH | ||||
| 185. 67 | 206. 3 | 13BeH | ||||
| 206. 3 | 226. 93 | 16BeH | ||||
| CO | 11. 534 | 15. 379 | 13CO | |||
| 23. 068 | 26. 913 | C17O | ||||
| 26. 913 | 30. 757 | 17CO | ||||
| 30. 757 | 34. 602 | C18O | ||||
| 34. 602 | 38. 447 | 14CO | ||||
| 53. 825 | 57. 670 | 15CO | ||||
| HBr | 33. 88 | 50. 82 | 3HBr | |||
| 152. 48 | 169. 42 | 2HBr | ||||
| 203. 30 | 220. 25 | H77Br | ||||
| 186. 36 | 203. 30 | H85Br | ||||
| 169. 42 | 186. 36 | H84Br | ||||
| 220. 25 | 237. 19 | H82Br | ||||
| HCl | 169. 44 | 190. 62 | 2HCl | |||
| 232. 98 | 254. 16 | 3HCl | ||||
| 127. 08 | 148. 26 | H37Cl | ||||
| 105. 90 | 127. 08 | 3HCl | ||||
| 254. 16 | 275. 34 | 2H37Cl | ||||
| 148. 26 | 169. 44 | 3H37Cl | ||||
| LiF | 5. 38 | 8. 07 | 6LiF | |||
| 24. 21 | 26. 90 | 6Li18F | ||||
| 16. 14 | 18. 83 | Li18F | ||||
| 13. 45 | 16. 14 | 6LiF | ||||
| 21. 52 | 24. 21 | 6Li18F | ||||
| 18. 83 | 21. 52 | 6LiF | ||||
|
|
|
Продолжение таблицы 4. 3
| Вариант | Молекула A | Под вариант |
| j | Молекула B | |
| HI | 39. 066 | 52. 088 | 2HI | |||
| 91. 154 | 104. 176 | 3HI | ||||
| 143. 242 | 156. 264 | 2H129I | ||||
| 104. 176 | 117. 198 | 3H131I | ||||
| 130. 220 | 143. 242 | H129I | ||||
| 117. 198 | 130. 220 | H131I | ||||
| CsI | 0. 0944 | 0. 1416 | Cs125I | |||
| 0. 5192 | 0. 5664 | 135Cs125I | ||||
| 0. 6608 | 0. 7080 | 134Cs129I | ||||
| 0. 6136 | 0. 6608 | Cs129I | ||||
| 0. 5664 | 0. 6136 | 135CsI | ||||
| 0. 7080 | 0. 7552 | 134CsI | ||||
| OH | 189. 20 | 227. 04 | O2H | |||
| 416. 24 | 454. 08 | 17O2H | ||||
| 491. 92 | 529. 76 | 17OH | ||||
| 567. 60 | 605. 44 | O3H | ||||
| 529. 76 | 567. 60 | 18O2H | ||||
| 454. 08 | 491. 92 | 18OH | ||||
| NaH | 29. 40 | 39. 20 | Na2H | |||
| 58. 80 | 68. 60 | 24Na2H | ||||
| 127. 40 | 137. 20 | 22NaH | ||||
| 98. 00 | 107. 80 | 24NaH | ||||
| 88. 20 | 98. 00 | 22Na3H | ||||
| 137. 20 | 147. 00 | Na3H | ||||
| SiH | 45. 01 | 59. 99 | Si2H | |||
| 165. 00 | 180. 00 | Si3H | ||||
| 105. 00 | 120. 00 | 29SiH | ||||
| 195. 00 | 210. 00 | 29Si2H | ||||
| 225. 00 | 240. 00 | 30SiH | ||||
| 210. 00 | 225. 00 | 30Si3H | ||||
| HF | 123. 15 | 164. 00 | 2HF | |||
| 205. 25 | 246. 30 | 3H18F | ||||
| 246. 30 | 287. 35 | 2H18F | ||||
| 492. 60 | 533. 65 | 3HF | ||||
| 533. 65 | 574. 70 | H18F | ||||
| 369. 45 | 410. 50 | 2HF | ||||
| NO | 17. 05 | 20. 46 | N18O | |||
| 44. 33 | 47. 74 | N17O | ||||
| 34. 10 | 37. 51 | 15N18O | ||||
| 30. 69 | 34. 10 | 15NO | ||||
| 40. 92 | 44. 33 | 15N17O | ||||
| 37. 51 | 40. 92 | 13NO | ||||
Продолжение таблицы 4. 3
| Вариант | Молекула A | Под вариант |
| j | Молекула B | |
| SO | 8. 64 | 10. 08 | S18O | |||
| 18. 72 | 20. 16 | 34SO | ||||
| 14. 40 | 15. 84 | S17O | ||||
| 17. 28 | 18. 72 | 36SO | ||||
| 15. 84 | 17. 28 | 33S17O | ||||
| 12. 96 | 14. 40 | 33SO | ||||
| ClO | 6. 25 | 7. 50 | 37ClO | |||
| 13. 75 | 15. 00 | Cl17O | ||||
| 18. 75 | 20. 00 | 37Cl18O | ||||
| 12. 50 | 13. 75 | Cl18O | ||||
| 15. 00 | 16. 25 | 37Cl17O | ||||
| 10. 00 | 11. 25 | 37ClO | ||||
| CN | 3. 80 | 7. 60 | 13C N | |||
| 15. 20 | 19. 00 | 13C15N | ||||
| 38. 00 | 41. 80 | 14CN | ||||
| 22. 80 | 26. 60 | C13N | ||||
| 53. 20 | 57. 00 | C15N | ||||
| 30. 40 | 34. 20 | 13C13N | ||||
| SH | 95. 95 | 115. 14 | S2H | |||
| 211. 09 | 230. 28 | 33S2H | ||||
| 268. 66 | 287. 85 | 33S3H | ||||
| 191. 90 | 211. 09 | 34S2H | ||||
| 172. 71 | 191. 90 | 34S3H | ||||
| 153. 52 | 172. 71 | S3H | ||||
| FO | 8. 84 | 11. 05 | F18O | |||
| 22. 10 | 24. 31 | F17O | ||||
| 15. 47 | 17. 68 | F18O | ||||
| 19. 89 | 22. 10 | 18FO | ||||
| 17. 68 | 19. 89 | 18F18O | ||||
| 13. 26 | 15. 47 | 18F17O | ||||
| HB | 144. 24 | 168. 28 | 2HB | |||
| 216. 36 | 240. 4 | 3HB | ||||
| 240. 4 | 264. 44 | 2H10B | ||||
| 264. 44 | 288. 48 | 3H10B | ||||
| 96. 16 | 120. 2 | H10B | ||||
| 120. 2 | 144. 24 | 3HB | ||||
| PH | 51. 74 | 69. 04 | P2H | |||
| 138. 08 | 155. 34 | P3H | ||||
| 224. 38 | 241. 64 | P2H | ||||
| 103. 56 | 120. 82 | 30P3H | ||||
| 120. 82 | 138. 08 | 30P2H | ||||
| 172. 6 | 189. 86 | P2H | ||||
|
|
|
Продолжение таблицы 4. 3
| Вариант | Молекула A | Под вариант |
| j | Молекула B | |
| BeO | 13. 20 | 16. 50 | Be18O | |||
| 52. 8 | 56. 10 | Be17O | ||||
| 39. 6 | 42. 90 | Be18O | ||||
| 26. 4 | 29. 70 | 7BeO | ||||
| 46. 2 | 49. 50 | 7Be18O | ||||
| 19. 8 | 23. 10 | 7Be17O | ||||
| NH | 133. 32 | 166. 65 | N2H | |||
| 433. 29 | 466. 62 | N3H | ||||
| 333. 3 | 366. 63 | 15NH | ||||
| 399. 96 | 433. 29 | 13NH | ||||
| 299. 97 | 333. 30 | 15N2H | ||||
| 366. 63 | 399. 96 | 15N3H | ||||
| 2H81Br | 16. 9795 | 25. 4640 | 2H 79Br | |||
| 59. 416 | 67. 90 | 3H 79Br | ||||
| 110. 344 | 118. 83 | 2H 80Br | ||||
| 76. 392 | 84. 88 | 3H 80Br | ||||
| 127. 32 | 135. 81 | H 79Br | ||||
| 93. 368 | 101. 86 | H 80Br | ||||
| NaO | 5. 95 | 6. 80 | Na18О | |||
| 7. 65 | 8. 50 | 24Na18О | ||||
| 12. 75 | 13. 60 | 22NaО | ||||
| 9. 35 | 10. 20 | 24NaО | ||||
| 4. 25 | 5. 10 | 22Na18О | ||||
| 11. 05 | 11. 90 | Na17О | ||||
| LiO | 9. 64 | 12. 05 | Li18O | |||
| 16. 87 | 19. 28 | 8LiO | ||||
| 31. 33 | 33. 74 | 6LiO | ||||
| 21. 69 | 24. 10 | Li18O | ||||
| 36. 15 | 38. 56 | 6LiO | ||||
| 26. 51 | 28. 92 | 6Li18O | ||||
| H37Cl | 42. 56 | 63. 83 | H35Cl | |||
| 106. 35 | 127. 62 | 2H35Cl | ||||
| 276. 51 | 297. 78 | 3H35Cl | ||||
| 148. 89 | 170. 16 | 2H37Cl | ||||
| 233. 97 | 255. 24 | 3H37Cl | ||||
| 191. 43 | 212. 70 | 2H35Cl | ||||
| CH | 144. 55 | 173. 46 | C2H | |||
| 404. 74 | 433. 65 | 13C2H | ||||
| 289. 1 | 318. 01 | C3H | ||||
| 462. 56 | 491. 47 | 13C3H | ||||
| 346. 92 | 375. 83 | 13C2H | ||||
| 173. 46 | 202. 37 | C2H | ||||
Продолжение таблицы 4. 3
| Вариант | Молекула A | Под вариант |
| j | Молекула B | |
| SiO | 7. 25 | 8. 70 | Si18O | |||
| 10. 15 | 11. 60 | Si17O | ||||
| 18. 85 | 20. 30 | 29Si18O | ||||
| 13. 05 | 14. 50 | 30Si17O | ||||
| 21. 75 | 23. 20 | 29SiO | ||||
| 15. 95 | 17. 40 | 30SiO | ||||
|
|
|



