 |
3.3. Полимеразная цепная реакция (ПЦР)
|
|
|
|
3. 3. Полимеразная цепная реакция (ПЦР)
ПЦР – искусственный процесс многократного копирования (амплификации) специфической последовательности ДНК, осуществляемый in vitro. Копирование ДНК при ПЦР осуществляется специальным ферментом - ДНК-полимеразой, который, двигаясь по одиночной цепи ДНК (матрице), синтезирует комплементарную ей последовательность ДНК. Разработан этот метод в 1983 году американским ученым Кэри Муллисом, за что был удостоен Нобелевской премии по химии в 1993 г., а первое сообщение об использовании в практике уже появилось в 1985 г. [6]. С момента возникновения идеи многократного увеличения числа копий искомой молекулы ДНК прошло сравнительно немного времени, тем не менее технология ПЦР совершила гигантский рывок и стала неотъемлемой частью рутинной лабораторной практики, продолжая при этом совершенствоваться и развиваться.
3. 3. 1. Принцип метода ПЦР
Основной принцип ПЦР состоит в том, что реакция полимеризации (синтеза полимерной цепи ДНК из мономерных нуклеотидных звеньев) инициируется специфическими праймерами (короткими фрагментами «затравочной» ДНК) в каждом из множества повторяющихся циклов, которые кодируют любой биологический признак микроорганизма (структуры микроба, фактор патогенности, устойчивость к химиопрепарату, видовой признак и т. д. ). Специфичность ПЦР определяется способностью праймеров «узнавать» строго определенный участок ДНК и связываться с ним по принципу молекулярной комплементарности [7].
Для амплификации используются синтетические олигонуклеотидные затравки – праймеры - обычно длиной 10 - 25 нуклеотидов. Качество праймеров является определяющим фактором при проведении ПЦР. Специфичность и чувствительность метода зависит от их первичной структуры, длины и концентрации. Обычно задачу выбора амплифицируемого фрагмента ДНК и подбора последовательности первичной структуры праймеров берет на себя фирма-производитель набора, гарантируя специфичность данной системы. В настоящее время на рынке сложилось положение, когда благодаря знанию первичной структуры и связанных с нею структурно-функциональных особенностей конкретного возбудителя, возможно создание нескольких вариантов пар праймеров. Сравнительная оценка их диагностической значимости представляет собой отдельную существенную проблему, обычно решаемую в крупных диагностических центрах.
|
|
|
Первичная структура праймеров подбирается, исходя из первичной структуры выбранного консервативного участка генома данного возбудителя. При этом стремятся, чтобы величина амплифицируемого фрагмента находилась в пределах 200 - 700 пар нуклеотидов, длина праймеров находилась в пределах 18 - 25 нуклеотидов (с уменьшением длины праймера снижается его специфичность - возрастает вероятность случайного связывания праймера с различными участками генома). Первичная структура праймеров должна содержать примерно одинаковое количество А-Т и Г-Ц пар, при этом желательно избегать гуанина или цитозина на 3`-концах, чтобы уменьшить вероятность неспецифической димеризации праймеров при отжиге. С той же целью стремятся, чтобы первичная структура используемых праймеров не содержала комплементарных участков длиннее 2 пар нуклеотидов. При подборе праймеров для мультиплексной ПЦР необходимо, чтобы определяемые праймерами размеры амплифицированных фрагментов для разных возбудителей существенно различались или каждая пара праймеров несла свою метку. Несмотря на хорошо разработанные теоретические и практические правила, подбор праймеров до настоящего времени в значительной мере является процессом эмпирическим [8].
|
|
|
В обычной реакции ПЦР используется пара праймеров, которые «ограничивают» амплифицируемый участок с двух сторон, связываясь с противоположными цепями ДНК-матрицы. Для многократного увеличения количества копий исходной ДНК нужна цикличность реакции.
Как правило, при проведении ПЦР выполняется 20 – 35 (до 40) циклов, каждый из которых состоит из трех технологических стадий (рис 12):
Ø денатурация, или «плавление» ДНК, когда происходит расплетение двойной спирали и расхождение нитей ДНК (протекает при 99–95о С в течение 30 – 40 сек. );

Рис. 12. Стадии ПЦР
[https: //studfile. net/html/2706/812/html_4ple1lJQlF. MlqU/img-QfWpx6.png]
Ø связывание (отжиг) праймеров с матричной ДНК (для каждой пары праймеров характерна своя температура гибридизации в интервале 50 – 65 о С, время отжига 20 – 60 сек. );
Ø элонгация, или удлинение цепи идет с участием фермента ДНК-полимеразы при температуре 70 – 72о С (20 – 40 сек. ).
Смена этапов каждого цикла осуществляется путем изменения температуры реакционной смеси. После температурной денатурации двухцепочечной ДНК образуются одноцепочечные молекулы, к которым присоединяются небольшие олигонуклеотиды - праймеры. Праймеры присоединяются только к комплементарному участку ДНК на обеих цепях ДНК и ограничивают амплифицируемый фрагмент с двух сторон. К 3'концу праймера прикрепляется ДНК-полимераза и на ДНК-матрице синтезируется её копия.
Синтез ДНК протекает только между праймерами. Каждый вновь синтезируемый фрагмент ДНК служит матрицей для синтеза двух новых нитей в следующем цикле амплификации. При многократном повторении этих стадий и оптимальном сочетании компонентов реакционной смеси происходит экспоненциальное увеличение количества ампликонов до 2n, где n - число циклов амплификации (рис. 13).
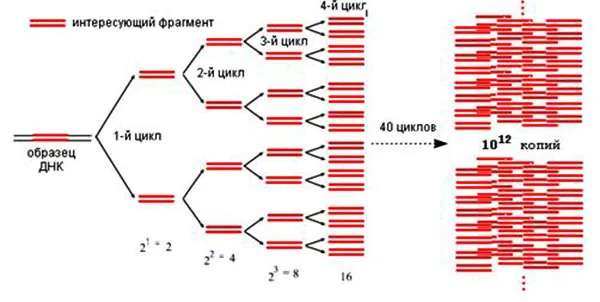
Рис. 13. Схема ПЦР
[https: //i2. wp. com/mkb2. ru/wp-content/uploads/2015/04/0b2f45841914280991fc91308d60d7f5.jpg]
В реакции используются термостабильные ДНК-полимеразы, выдерживающие высокую температуру на всех этапах цикла ПЦР в течение нескольких десятков циклов. Количество коммерчески доступных термостабильных ДНК-полимераз, отличающихся некоторыми своими свойствами, достаточно велико. Наиболее часто используется Taq-полимераза, первоначально выделенная из термофильного микроорганизма Thermus aquaticus. Другие полимеразы чаще применяются для особых приложений ПЦР [8, 9].
|
|
|


