 |
3.3.2. Организация ПЦР-лаборатории и оборудование
|
|
|
|
3. 3. 2. Организация ПЦР-лаборатории и оборудование
Организация ПЦР-лаборатории и список оборудования регламентированы Методическими указаниями [10, 11]. Комплект необходимого оборудования для проведения ПЦР должен включать приборы для выделения нуклеиновых кислот, их амплификации и детекции результатов. Все оборудование должно быть исправным, иметь технический паспорт, инструкцию по эксплуатации, допущено для использования в Российской Федерации (сертифицировано). Все приборы должны соответствовать нормам безопасности.
Для предотвращения контаминации исходных образцов используют одноразовые пробирки с плотно закрывающимися крышками и наконечники к микродозаторам, термостаты с твердотельным термоблоком, специальные контейнеры для сброса использованных наконечников и пробирок. Смена наконечников является обязательной после каждой проведенной манипуляции.
Для каждого отдельного помещения предусмотрено наличие холодильников и морозильников для поддержания определенной температуры, вортексов и роторов для перемешивания, центрифуг различной мощности для перемешивания и разделения образцов. Также необходимо наличие комплекта дозаторов различного диапазона объемов и подходящих для них наконечников, штативов для микропробирок, самих микропробирок (центрифужных, градуированных и пр. ) различных объемов. Все комнаты должны быть оснащены бактерицидными рецикуляторами для дезинфекции воздуха при помощи УФ, все рабочие поверхности и наружные поверхности корпусов приборов должны быть устойчивы к дезинфекции. Помимо перечисленного списка каждая зона лаборатории должны содержать конкретный набор приборов, необходимых для выполнения соответствующих задач.
|
|
|
Организация зон лаборатории. Зона приема, регистрации и первичной обработки материала должна быть оборудована центрифугами для осаждения и разделения компонентов проб.
В зоне выделения нуклеиновых кислот необходимо наличие:
• абактериального бокса для защиты исследователя от патогенных агентов, передающихся воздушно-капельным путем;
• процессора магнитных частиц для экстракции НК;
• нанофотометра для определения количества и качества выделенной из образка ДНК/РНК;
• термостата для поддержания постоянной температуры в пробирках, помещенных в гнезда термоблока;
• дистиллятора для получения дистиллированной воды.
Зона приготовления реакционной смеси и проведения ПЦР должна содержать:
• амплификатор, необходимый для нагрева/охлаждения пробирок;
• бокс для стерильных работ для обеспечения защиты от контаминации при выделении ДНК и подготовке реакционной смеси.
Обязательными для зоны детекции результатов являются:
• камера для электрофореза – разделения продуктов амплификации нуклеиновых кислот, а также источник питания, преобразующий переменный ток в постоянный;
• система гель-документации для регистрации результатов и воспроизведения электрофореграмм, включающая в себя трансиллюминатор для детекции результатов в УФ спектре, а также компьютер;
• электронные прецизионные весы для приготовления агарозного геля, который используется при электрофорезе;
• электрическая плитка для тех же целей.
Зона дезинфекции материалов содержит паровой стерилизатор для обезвреживания образцов водяным паром под давлением.
3. 3. 3. Этапы ПЦР
Постановка ПЦР проводится в 5 этапов.
Первый этап - выделение (экстракция) ДНК из клеток (рис. 14). Метод выделения ДНК зависит от изучаемого микроорганизма и вида материала для исследований.
|
|
|

Рис. 14. Экстракция ДНК (фото авторов)
На этой стадии клетки лизируют одним из способов: а) ферментативно (лизоцим); б) химически; в) термически (90 – 95 º С). Клеточный дебрис (остаток клеток, окруженный плазматической мембраной) осаждают центрифугированием, при этом ДНК остается в растворе. В некоторых случаях возникает необходимость в концентрировании ДНК. Для этого находящуюся в растворе ДНК адсорбируют на сорбенте, а затем проводят десорбцию ДНК небольшим количеством элюента. Концентрируют ДНК также с использованием осаждающих веществ, после чего осевшую ДНК ресуспендируют в небольшом объеме воды [12].
Второй этап — приготовление реакционной смеси. В микроцентрифужных пробирках объемом 0, 5 или 0, 2 мл смешивают компоненты реакционной смеси так, чтобы объем общей реакционной смеси составлял 25, 50 или 100 мкл. Все компоненты реакции вносят микропипеткой, причём каждый раз наконечник меняют во избежание контаминации.
Обязательные компоненты реакционной смеси (таб. 1):
а) раствор искомой ДНК, выделенной на предыдущей стадии;
б) смесь четырёх дНТФ (дезоксинуклеотидтрифосфатов) — строительный материал ДНК;
в) термостабильная ДНК-полимераза - Taq-полимераза (не денатурирует при 96 º С), осуществляющая полимеризацию нуклеотидов;
г) два синтетических праймера (прямой и обратный) — короткие, длиной 10 – 25 оснований, одноцепочечные олигонуклеотиды, которые связываются с комплементарными структурами исследуемой ДНК и с которых начинается биосинтез множественных копий;
д) специфический буфер, который используется для растворения и функционирования Taq-полимеразы в присутствии ионов магния, а также для создания определённых значений рН и концентрации солей.
Таблица 1
Роль компонентов реакционной смеси ПЦР
| Компоненты реакционной смеси ПЦР | Роль в реакции |
| 1. ДНК-матрица | Матрица для синтеза дочерних цепей |
| 2. Taq-полимераза | осуществляет полимеризацию нуклеотидов |
| 3. Дезоксинуклеозиды трифосфаты | Мономеры для наращивания цепи |
| 4. Два праймера – прямой и обратный | Служат затравкой для ДНК-полимеразы |
| 5. Ионы магния (Мg2+) | Являются кофакторами для ДНК-полимеразы |
| 6. ПЦР-буфер | Создание оптимальных условий для максимальной активности и стабильности ДНК-полимеразы |
| 7. Вода | Среда для протекания реакции, доведение объема реакционной смеси до необходимого |
|
|
|
Третий этап — программирование температурного цикла и проведение амплификации заданного фрагмента ДНК в термоциклере (рис. 15). На выделенной ДНК-матрице происходит процесс многократного копирования ДНК в ходе последовательно сменяющихся циклов. Пробирки с реакционной смесью размещают в приборе — термоциклере. Температурные режимы циклов в термоциклере изменяются в соответствии с заданной программой.

Рис. 15. Термоциклер (фото авторов)
Четвертый этап (если система учета не Real-Time) - визуализация получаемых копий ДНК и регистрация результатов реакции. Образуемый высококонцентрированный раствор ампликонов ДНК прозрачен. Поэтому для выявления ДНК проводят электрофорез в агарозном геле, содержащем флюоресцирующий в УФ-свете ДНК-краситель - бромид этидия. ДНК движется в электрическом поле, взаимодействует с этидием бромидом и при просматривании в трансиллюминаторе (источник УФ-света) выглядит в виде светящейся оранжевой полоски. Полученные результаты можно документировать, фотографируя электофореграммы с использованием оранжевого светофильтра.

Рис. 16. Камера для электрофореза с агарозным гелем
[https: //studfile. net/html/2706/365/html_9hnZPJKnFI. 1k3f/img-7XDhVb.jpg]
При проведении электрофореза агарозный гель (0, 5–4 %) с лунками для образцов опускают в аппарат так, чтобы лунки находились в области катода (рис. 16). В камеру для электрофореза заливают трис-ацетат-ЭДТА-буфер. Толщина слоя жидкости над гелем должна составлять 1 – 2 мм. Образец смешивают с загрузочным красителем в соотношении 1: 6 и вносят 6 – 20 мкл в лунку в геле. Обычно одновременно исследуют много образцов. Загрузочный краситель (зеленый, синий) имеет скорость движения, схожую с ДНК, поэтому по его перемещению судят о местонахождении ДНК в геле. В зависимости от плотности тока, время проведения электрофореза составляет от 30 мин до 24 ч. После проведения электрофореза гель вынимают из камеры и переносят на столик трансиллюминатора, где бромистый этидий, связавшийся с ДНК, флюоресцирует в УФ-свете (230 нм), давая оранжевое свечение (рис. 17).
|
|
|
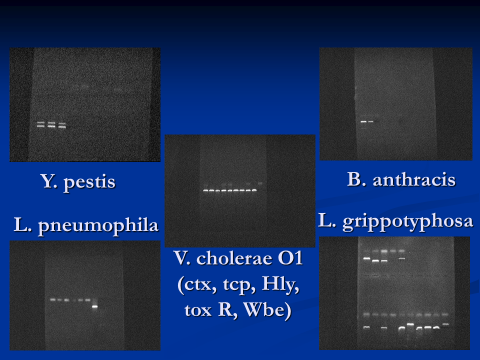
Рис. 17. Амплифицированные участки ДНК в агарозном геле после электрофореза у различных возбудителей (фото авторов)
Пятый этап — анализ и интерпретация результатов реакции. Для оценки результатов учитывают опытные лунки, а также лунки с положительным и отрицательным контролем. При интерпретации результатов ПЦР следует понимать, что могут быть получены как ложноположительные, так и ложноотрицательные результаты. Ложноположительные результаты могут наблюдаться в результате контаминации при нарушении правил проведения ПЦР. Ложноотрицательные результаты могут наблюдаться в результате снижения чувствительности ПЦР при ингибировании реакции компонентами биологических образцов.
|
|
|


