 |
Поведение в экстремальных условиях 1 страница
|
|
|
|

5. 1. СЕРДЦЕ
5. 1. 1. Физиологические свойства сердечной мышцы
Сократимость. Сердце сокращается ритмически. Разные отделы сердца сокращаются в следующей последовательности: сначала сокращаются предсердия, потом желудочки.
Сердечная мышца подчиняется закону «все или ничего». На пороговое раздражение сердечная мышца дает сокращение максимальной амплитуды.
Указанное свойство определяется особенностями морфологического строения сердечной мышцы. Между отдельными мышечными клетками сердечной мышцы имеются так называемые вставочные диски, или участки плотных контактов— нексусы, образованные плазматическими мембранами двух соседних миокардиальных клеток. Мембраны на уровне вставочных дисков обладают очень низким электрическим сопротивлением, и поэтому возбуждение распространяется от волокна к волокну беспрепятственно, охватывая миокард целиком. Сердечную мышцу, состоящую из морфологически разъединенных, но функционально объединенных мышечных волокон, принято считать функциональным синцитием.
Растяжимость — способность сердечной мышцы под влиянием растягивающей силы, в частности давления, увеличивать тину без заметного нарушения структуры.
Эластичность — способность сердечной мышцы восстанавливать исходное состояние после прекращения действия деформирующей силы.
Возбудимость. В ответ на раздражение сердечная мышца возбуждается, порождая биопотенциал, и сокращается.
Сердце в период систолы абсолютно невозбудимо — абсолютная рефрактерная фаза. В диастолу наблюдается фаза относительной рефрактерности, завершающаяся фазой экзальтации (рис. 5. 1).

Рис. 5. 1. Изменения возбудимости сердечной мышцы в соответствии с фазами сокращения сердца:
|
|
|
1 — абсолютная рефрактерная фаза; 2 — относительная рефрактерная фаза;
3 — фаза экзальтации
Наличие периода абсолютной рефрактерной фазы в некоторой степени определяет ритмические сокращения сердца.
Длительная фаза абсолютной рефрактерности препятствует возникновению тетанических сокращений сердца.
Экстрасистолы. Дополнительное раздражение сердечной мышцы в фазу относительной рефрактерности и экзальтации приводит к внеочередному сокращению — экстрасистоле. Предсердные экстрасистолы характеризуются тем, что после них наблюдается пауза обычной продолжительности. После желудочковой экстрасистолы
Ш\Л_
 ДЛЛ fl
ДЛЛ fl
Б‘ • Т '
наблюдается удлиненная компенсаторная пауза (рис. 5. 2), поскольку очередной импульс из синоатриального узла поступает к желудочкам сердца в абсолютную рефрактерную фазу от предыдущего сокращения. Амплитуда экстрасистолы может быть разной в зависимости от того, в какую фазу изменения возбудимости от предыдущего сокращения попадает раздражающий импульс.
5. 1. 2. Сердечный цикл (кардиоцикл)
Работа сердца проявляется последовательными ритмическими сокращениями предсердий и желудочков, чередующимися с их расслаблениями. Сокращение любого отдела сердца называется систолой, расслабление — диастолой, общий покой — паузой. Систола предсердий происходит на фоне диастолы желудочков, вслед за тем возникает систола желудочков, в то время как предсердия находятся в диастолическом расслаблении. После этого вся мышца сердца приходит в состояние покоя — паузу. После паузы наступает новое чередование работы сердца в том же порядке. Каждое повторение последовательных сокращений сердца и покоя называется одиночным циклом сердечной деятельности.
Одиночный цикл сердечной деятельности при 75 сокращениях сердца в минуту составляет 0, 8 с.
|
|
|
Одиночный сердечный цикл включает систолу предсердий, диастолу предсердий, систолу и диастолу желудочков и паузу (рис. 5. 3).

Рис. 5. 3. Соотношение во времени фаз и периодов цикла сердечной деятельности. Зачерненное пространство соответствует периоду систолы предсердий и желудочков; серым цветом обозначены периоды закрытого состояния атриовентрикулярных и полулунных клапанов. На схеме показаны два кардиоцикла
Благодаря наличию клапанов кровь в сердце движется в одном направлении.
Систола предсердий длится 0, 1 с, диастола — 0, 7 с. Давление в предсердиях во время систолы повышается до 5—8 мм рт. ст.
Систола желудочков длится 0, 33 с. Она состоит из двух периодов и четырех фаз.
Период напряжения (0, 08 с) состоит из двух фаз:
• асинхронного сокращения (0, 05 с) — происходит асинхронное, неодновременное сокращение различных частей миокарда желудочков, при этом давление в полостях желудочков сердца не увеличивается;
• изометрического сокращения (0, 03 с) — происходит увеличение напряжения мышечных волокон желудочков без изменения их длины. В начале этой фазы атриовентрикулярные клапаны сердца закрываются, а полулунные клапаны еще не открыты, т. е. все клапаны сердца закрыты.
В период напряжения давление в желудочках постепенно нарастает, и когда оно становится равным 70—80 мм рт. ст. в левом желудочке и 15—25 мм рт. ст. в правом, происходит открытие полулунных клапанов аорты и легочной артерии. Наступает период изгнания крови (0, 25 с), который состоит также из двух фаз. Первая фаза — фаза быстрого изгнания крови (0, 12 с). В это время давление в полостях желудочков продолжает быстро нарастать, что обеспечивает переход большей части крови из желудочков в аорту и легочную
артерию. По мере уменьшения объема крови в желудочках нарастание давления в них замедляется, и, следовательно, уменьшается отток крови в аорту и легочную артерию. Наступает вторая фаза периода изгнания крови — фаза медленного изгнания (0, 13 с), на высоте которой давление в желудочках достигает максимальных величин: 120-130 мм рт. ст. в левом и 25-30 мм рт. ст. в правом.
В конце фазы медленного изгнания крови миокард желудочков начинает расслабляться и наступает диастола желудочков (0, 47 с). Давление крови в желудочках становится меньше ее давления в аорте и легочной артерии, и кровь из них начинает оттекать обратно в желудочки. При этом кровь, затекая в карманы полулунных клапанов аорты и легочной артерии, смыкает их и тем самым перекрывает сообщение этих сосудов с полостями желудочков, что предотвращает дальнейший отток крови в желудочки. Время от начала расслабления желудочков до закрытия полулунных клапанов называется протодиастолическим периодом (0, 04 с). Миокард желудочков продолжает расслабляться дальше, но уже при закрытых атриовентрикулярных и полулунных клапанах, т. е. в условиях замкнутости полостей желудочков. Этот этап диастолы называется периодом изометрического расслабления (0, 08 с). К концу этого периода давление в желудочках становится ниже, чем в предсердиях, поэтому кровь, заполняющая предсердия, открывает атриовентрикулярные клапаны и поступает в желудочки. Наступает период наполнения желудочков кровью (0, 35 с), состоящий из трех фаз. Фаза быстрого пассивного наполнения (0, 08 с), в процессе которой поступление крови в желудочки обеспечивается более высоким ее давлением в предсердиях. По мере наполнения желудочков кровью давление в них постепенно увеличивается и скорость их наполнения снижается — это фаза медленного пассивного наполнения (0, 17 с). Вслед за ней наступает фаза активного наполнения (0, 1 с), формируемая систолой предсердий. За счет систолы предсердий объем крови в желудочках увеличивается примерно на 8%. Но этот небольшой объем дополнительно нагнетаемой крови играет существенную роль в регуляции силы сокращения желудочков.
|
|
|
На рис. 5. 4 представлен кардиоцикл левой половины сердца.
Из 0, 7 с диастолы предсердий 0, 3 с совпадают с систолой желудочков, а 0, 4 с — с диастолой желудочков, т. е. в течение 0, 4 с пред-
 |
|
 |
| ||||||
| ||||||
| ||||||
 |
 | ||||
| ||||
|
|
|
сердия и желудочки находятся в состоянии диастолы. Этот период в деятельности сердца называется общей паузой сердца. За 0, 1 с до окончания диастолы желудочков начинается следующая систола предсердий и кардиоцикл повторяется снова.
В состоянии покоя объем крови, находящийся в желудочках в конце периода наполнения, составляет от 70 до 140 мл и называется конечно-диастолическим объемом.
5. 1. 3. Автоматия сердца
Сердце, изолированное из организма и помещенное в соответствующий питательный физиологический раствор, продолжает ритмически сокращаться.
Способность сердечной мышцы ритмически сокращаться под влиянием импульсов, формирующихся в ней самой, получило название автоматия сердца.
Наличие центров автоматии в сердце доказывает опыт с наложением лигатур на изолированное сердце. При наложении 1-й лигатуры (отделения) между венозным синусом и правым предсердием сердце останавливается. В этой области располагается ведущий центр автоматии сердца — задаватель ритма (пейсмекер) — синоатриальный узел. Сердце с наложенной «лигатурой отделения» через некоторое время снова самостоятельно начинает сокращаться. Сокращение сердца после наложения «лигатур отделения» можно ускорить, если на область предсердно-желудочковой перегородки наложить вторую лигатуру (раздражения). Здесь располагается второй атриовентрикулярный узел автоматии. После наложения первой и второй лигатур наложение их на другие участки сердца не вызывает его сокращений.
Установлено, что автоматией обладают малодифференцированные атипические мышечные волокна, которые образуют проводящую систему сердца. Проводящая система включает в себя главные узлы автоматии: синоатриальный узел, расположенный в стенке правого предсердия между местом впадения верхней полой вены и правым ушком; атриовентрикулярный узел, расположенный в межпредсердной перегородке на границе предсердий и желудочков. В состав проводящей системы сердца входит также пучок Гиса, который начинается от атриовентрикулярного узла, затем разделяется на правую и левую ножки, идущие к желудочкам. Ножки пучка Гиса разделяются на более тонкие проводящие пути, заканчивающиеся волокнами Пуркинье, которые контактируют с клетками сократительного миокарда.
 Ведущим узлом автоматии в сердце является синоатриальный узел— водитель ритма (пейсмекер) сердца 1-го порядка. Атриовентрикулярный узел является водителем ритма сердца 2-го поряд-
Ведущим узлом автоматии в сердце является синоатриальный узел— водитель ритма (пейсмекер) сердца 1-го порядка. Атриовентрикулярный узел является водителем ритма сердца 2-го поряд-
|
|
|
1 1 Нормальная физиология
ка. Его способность к автоматик примерно в 2 раза меньше, чем у синоатриального узла. Автоматия волокон пучка Гиса еще меньше. И наконец, волокна Пуркинье обладают наименьшей способностью к автоматии. В сердце существует, таким образом, градиент авто- матии — уменьшение способности к автоматии различных отделов проводящей системы сердца по мере их удаления от синоатриального узла к верхушке сердца.
В норме возбуждение всех отделов сердца определяется ведущим синоатриальным узлом автоматии.
Свойства пейсмекера сердца:
• Пейсмекерный синоатриальный узел автоматии обладает повышенной возбудимостью по отношению к другим образованиям сердца, а также к влияниям гуморальной и нервной природы.
• Пейсмекер в норме навязывает ритм сокращений всему сердцу, в том числе атриовентрикулярному узлу автоматии.
• Пейсмекер обладает повышенной чувствительностью к химически воздействиям.
• В пейсмекере спонтанно возникает процесс деполяризации клеточных мембран.
• При повреждении ведущего пейсмекера сердца — синоатриального узла — его функцию компенсаторно может взять на себя атриовентрикулярный узел. Возбуждения в атриовентрикулярном узле возникают реже, чем в синоатриальном узле.
Узлы автоматии — типичные триггерные механизмы, возбуждение в них возникает при нарастании исходной возбудимости до критического уровня.
Теории автоматии сердца. Существуют эндогенные и экзогенные теории автоматии сердца.
Эндогенные теории связывают периодические возбуждения в узлах автоматии с накоплением в них в диастоле сердца ионов водорода, электролитов, молочной кислоты, ацетилхолина, адреналина и других биологически активных веществ, которые разрушаются в систолу.
Экзогенные теории отражают ту точку зрения, согласно которой на автоматию сердца влияют вещества, находящиеся в плазме крови, и электрическое поле сердца.
С помощью микроэлекгродных исследований установлено, что в клетках рабочего миокарда предсердий и желудочков мембранный потенциал покоя в интервалах между возбуждениями поддерживается на постоянном уровне. Клетки же синоатриального узла не способны длительно удерживать потенциал покоя.
Электрические процессы в клетках синоатриального узла. В клетках синоатриального узла наблюдается спонтанная деполяризация. В период диастолы в клетках синоатриального узла происходит постепенное уменьшение мембранного потенциала покоя, которое называется медленной диастолической деполяризацией (МДД). При достижении МДД критического уровня (около 50 мВ) возникает очередной потенциал действия пейсмекерной клетки, который затем распространяется по проводящей системе к миокарду предсердий и желудочков. Этот потенциал имеет малую крутизну подъема и малую выраженность плато. После завершения потенциала действия вновь развивается МДЦ (рис. 5. 5). У клеток атриовентрикулярного узла скорость спонтанной деполяризации значительно ниже и ритм потенциалов тоже.

Рис. 5. 5. Потенциал действия пейсмекерных клеток синоатриального узла. Стрелками показана МДД
Ионный механизм пейсмекерного потенциала. Три ионных потока определяют пейсмекерный потенциал:
• Поступление ионов Na+ и Са2+ через медленные управляемые каналы внутрь пейсмекерных клеток.
• Уменьшение проницаемости мембран пейсмекерных клеток для ионов К+.
• Увеличение выхода из пейсмекерных клеток ионов СГ в соответствии с электрическим градиентом.
В период между циклами возбуждения имеется довольно высокий медленный постоянный входящий ток ионов Na+ и в меньшей степени ионов Са2+. Поэтому в клетках синоатриального узла возникают натриевый и кальциевый равновесные потенциалы, противодействующие калиевому равновесному потенциалу.
Во время расслабления и покоя (диастола) предсердий происходит постепенное уменьшение проницаемости мембраны для ионов К+. В результате этого уменьшается калиевый равновесный потенциал.
Уменьшение потенциала покоя до —40 мВ вызывает открытие медленных натрий-кальциевых каналов, что приводит к возникновению быстрой деполяризации. Реполяризация обеспечивается открытием калиевых каналов. Уменьшение калиевой проницаемости соответствует постоянно входящему току натрия и кальция. Кроме того, в самом конце МДД увеличиваются входящие токи натрия и кальция, что также способствует спонтанной деполяризации.
Клетки синоатриального узла содержат большое количество ионов С1_, что существенно отличает их от всех остальных клеток сердца. В период между циклами возбуждения проницаемость мембраны для ионов С1~ медленно увеличивается, и хлор начинает выходить из клеток по градиенту концентрации. Это также способствует деполяризации мембраны.
В межспайковый период постепенно снижается активность №+, К'-АТФазы, что уменьшает градиент концентрации этих ионов снаружи и внутри клеток синоатриального узла и постепенно снижает потенциал покоя.
5. 1. 4. Электрические процессы в клетках рабочего миокарда
В отличие от клеток водителей ритма клетки миокарда в состоянии покоя характеризуются очень низкой проницаемостью для ионов Na+, поэтому спонтанных сдвигов мембранного потенциала в них не возникает.
Потенциалы действия, зарегистрированные в клетках рабочего миокарда в разных отделах сердца, различаются по форме, амплитуде и длительности.
Потенциал действия рабочего миокарда включает фазы (рис. 5. 6):
• деполяризации (фаза 0);
• быструю начальную реполяризацию (фаза 1);
• медленную реполяризацию — плато (фаза 2);
• быструю конечную реполяризацию (фаза 3);
• фазу покоя (фаза 4).
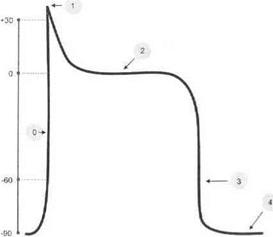
Рис. 5. 6. Потенциал действия клетки рабочего миокарда:
О— фаза деполяризации; 1 — фаза начальной быстрой реполяризации; 2 — фаза медленной реполяризации (плато); 3— фаза быстрой конечной реполяризации; 4 — фаза покоя
Фаза 0 обусловлена повышением натриевой проницаемости — активацией быстрых натриевых каналов мембран кардиомиоцитов. Во время пика потенциала действия в клетках миокарда происходит изменение знака мембранного потенциала (с —90 до +30 мВ). Деполяризация мембраны активирует медленные натрий-кальциевые каналы. Поток Са2+ внутрь миокардиоцитов по этим каналам приводит к развитию плато потенциала действия. В период плато натриевые каналы инактивируются и клетки находятся в состоянии абсолютной рефрактерности. В это время из кардиомиоцитов выходит поток ионов К, который обеспечивает быструю реполяризацию мембраны (фаза 3). Во время этой фазы кальциевые каналы
закрываются, падает входящий кальциевый ток, что ускоряет процесс реполяризации (рис. 5. 7).
В клетках рабочего миокарда предсердий и желудочков потенциал покоя поддерживается на более или менее постоянном уровне (—90 мВ) и определяется целиком концентрационным градиентом ионов К+.
|
|
 |
Форма потенциала действия сократительных кардиомиоцитов отличается от потенциала действия пейсмекерной клетки синоатриального узла. Во-первых, для пейсмекерных клеток характерно наличие МДЦ. Во-вторых, МДД медленно, плавно (особенно у клеток синоатриального узла) переходит в фазу быстрой деполяризации. В-третьих, у МДД пейсмекерных клеток нет плато реполяризации. В-четвертых, у пейсмекерных клеток отсутствует овершут (потенциал превышения). В-пятых, мембранный потенциал покоя (МПП) у пейсмекерных клеток значительно ниже (—55—60 мВ), чем у сократительных кардиомиоцитов (—90 мВ).
5. 1. 5. Электромеханическое сопряжение
Длительность и амплитуда потенциалов действия в сердечной мышце связаны с увеличением проницаемости мембран сократительных кардиомиоцитов для ионов Са2+. Возникновение потенциалов действия в кардиомиоцитах вызывает последовательную цепь событий, завершающуюся укорочением составляющих их миофибрилл.
Входящий в клетку кальций увеличивает длительность потенциалов действия и, как следствие, продолжительность рефрактерного периода. Кальций является важнейшим фактором в регуляции силы сокращения сердечной мышцы.
Серию последовательных явлений в клетке миокарда, начинающихся с пускового механизма сокращения — потенциала действия (ПД) и завершающихся укорочением миофибрилл, называют сопряжением возбуждения и сокращения (электромеханическим сопряжением).
Эндоплазматическая сеть сократительных кардиомиоцитов имеет ограниченный запас ионов Са2+. Скорость и амплитуду сокращения сердца в значительной степени определяет внеклеточный кальций.
Первичная активация натриевых каналов и развитие потенциалов действия активирует в кардиомиоцитах зависимые от натрия кальциевые каналы, через которые кальций поступает из межклеточной жидкости, а также из собственной эндоплазматической сети — источника эндогенного кальция. Ионы Са2+ в кардиомиоците соединяются с регуляторным кальций-реактивным белком тропонином. В результате повышается АТФазная активность поперечных мостиков тяжелого миозина, что обеспечивает образование актомиозинового комплекса и увеличение количества активных единиц, определяющих скольжение нитей актина.
Электромеханическая диссоциация. Блокада (например, фармакологическая) кальциевых каналов или значительное уменьшение содержания кальция в межклеточной жидкости приводит к так называемой электромеханической диссоциации. В результате дефицита кальция сила и частота сердечных сокращений уменьшаются. Полное удаление ионов Са2+ из перфузируемого через сердце раствора приводит к полному разобщению возбуждения и сокращения. При этом потенциалы действия (его начальная часть, обусловленная натриевым током) продолжают регистрироваться, но сокращения сердца не происходит.
Расслабление кардиомиоцитов. Расслабление кардиомиоцитов обусловлено удалением ионов Са2+ кальциевым насосом из про- тофибриллярного пространства в межклеточную среду, цистерны ретикулума и митохондрии.
5. 1. 6. Регуляция деятельности сердца
Различают несколько различных влияний на сердце, которые могут быть отрицательными и положительными (Дж. Эдельман):
• Хронотропное — изменение ритма.
• Инотропное — изменение силы сокращений.
• Батмотропное — изменение возбудимости.
• Дромотропное — изменение проводимости.
• Тонотропное (клинотропное) — изменение исходного тонуса.
Гемодинамическая регуляция деятельности сердца. В 1885 г. Н. Я. Чистович и И. П. Павлов на сердечно-легочном препарате, в котором искусственно изолировали большой круг кровообращения и сохраняли малый круг при искусственном дыхании животного, показали, что при увеличении давления крови, поступающей к правому предсердию, сердце увеличивает систолический и минутный объем. Это свойство сердечной мышцы получило в дальнейшем название закон Франка—Старлинга. Закон гласит: сила сердечных сокращений зависит от степени первоначального растяжения сердечной мышцы.
Систолический объем. Количество крови, выбрасываемой желудочком сердца за одну систолу, равно в среднем 60—70 мл. Причем оба желудочка сердца выбрасывают одинаковое количество крови.
Минутный объем. Количество крови, выбрасываемое каждым желудочком сердца за 1 мин, равно 70 мл х 60 = 4200 мл.
Объем крови, остающейся в желудочках после их систолы, равен 60—70 мл и называется конечно-систолическим, или резервным объемом.
Ушки сердца и его предсердия при их сокращении добавляют определенный объем крови к последующим сокращениям предсердий и желудочков (по принципу трамплина).
Сердце, таким образом, само регулирует величину своих сокращений. Этот тип регуляции сердечной деятельности получил название гемодинамическая регуляция.
При увеличении артериального давления при неизменном венозном притоке в систолу в желудочках сердца может оставаться некоторое количество крови (например, при пороке полулунных клапанов). При этом слегка перерастянутый остаточной кровью желудочек начинает совершать большую работу, преодолевая артериальное сопротивление на новом функциональном уровне. Устанавливается функциональная компенсация работы сердца. Нарушение компенсации ведет к сердечно-сосудистой недостаточности.
Согласованная работа левого и правого отделов сердца. В нормальных условиях оба отдела сердца работают согласованно. Если один из желудочков начинает выбрасывать большее количество крови, то через некоторое время систолические объемы левого и правого желудочков выравниваются.
Работа сердца. А = PH, где Р— сила сердечных сокращений, Н— высота (в среднем 1, 5 м), на которую проталкивается кровь.
За минуту сердце выбрасывает 4200 мл крови, за 1 ч — 4200 х 60 = = 252 000 мл крови. В час работа сердца равна 250 л х 1, 5 = 375 ктм/ч. В сутки — 8000 кгм. При физических нагрузках работа сердца возрастает до 30 000 кгм/сут.
Миогенные механизмы гемодинамической регуляции. Гетеро- метрический механизм опосредован внутриклеточными взаимодействиями и связан с изменением взаиморасположения актиновых и миозиновых нитей в миофибриллах кардиомиоцитов при растяжении миокарда кровью, поступающей в полости сердца. Растяжение миокардиоцитов приводит к увеличению количества миозиновых мостиков, способных соединять миозиновые и актиновые нити во время сокращения. Чем более растянут кардиомиоцит, тем на большую величину он может укоротиться при сокращении и тем более сильным будет сокращение.
Гомеометрическая авторегуляция сердца связана с определенными межклеточными отношениями и не зависит от предсистоличе- ского его растяжения. Ведущую роль в гомеометрической регуляции играют вставочные диски — нексусы, через которые миокардио- циты обмениваются ионами и информацией. Реализуется данная форма регуляции в виде эффекта Анрепа — увеличения силы сердечных сокращений при возрастании сопротивления в магистральных сосудах.
Разновидностью гомеометрической регуляции является ритмоинотропная зависимость — изменение силы сердечных сокращений при изменении частоты сердцебиений. Ритмоинотропная зависимость обусловлена изменением длительности потенциала действия миокардиоцитов и изменением количества экстрацеллюлярного кальция, входящего в миокардиоцит при развитии возбуждения.
Нейрогенная регуляция деятельности сердца. Определяется прежде всего периферическими внутрисердечными рефлексами. Рефлексогенные зоны сердца условно делятся на контролирующие «вход» (приток крови к сердцу), «выход» (отток крови от сердца) и кровоснабжение самой сердечной мышцы (расположены в устьях коронарных сосудов). При любом изменении параметров этих процессов возникают местные рефлексы, реализуемые через внутрисердечные метасимпатические узлы автономной нервной системы и направленные на ликвидацию отклонений гемодинамики. Так, при увеличении венозного притока и увеличении давления в устьях полых вен и в правом предсердии возникает рефлекс Бейнбриджа, проявляющийся в увеличении частоты сокращений сердца.
Влияние блуждающих нервов. В 1845 г. братья Вебер открыли тормозное (отрицательное хроноинотропное) действие блуждающих нервов на деятельность сердца (рис. 5. 8).

Рис. 5. 8. Влияние раздражения вагосимпатического ствола на деятельность сердца у лягушки. Стрелки — момент раздражения
Влияние блуждающих нервов на сердце осуществляется через узлы автоматии и проводящую систему сердца. При перерезке пучка Гиса раздражение блуждающих нервов перестает влиять на ритм сокращения желудочков.
Правый блуждающий нерв распространяет свои влияния на синоатриальный узел, урежая тем самым сердечные сокращения. Левый блуждающий нерв оказывает преимущественное влияние на атриовентрикулярный узел и способствует остановке сердца.
|
|
|



