 |
Первое начало термодинамики. Адиабатный процесс
|
|
|
|
Выражением закона сохранения и превращения энергии в термодинамических процессах является первое начало термодинамики - обобщение многочисленных экспериментальных результатов: изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме совершенной над системой (затраченной) работы dА’ и сообщенной ей теплоты dQ: dU = dA’ + dQ.
Если вместо совершенной над системой работы dA’ ввести равную ей по величине, но противоположную по знаку работу dA, совершенную системой над внешними телами (dA = - dA’), то тогда первое начало термодинамики можно сформулировать следующим образом: сообщаемая системе теплота расходуется на увеличение ее внутренней энергии и на совершение системой работы против внешних сил.
dQ = dU + dA.
В интегральной форме первое начало термодинамики может быть представлено в следующем виде:
Q = A + DU.
Когда система представляет собой периодически действующую машину, в которой газ или пар, или другое “рабочее тело” в результате некоторого процесса периодически возвращается в исходное состояние, DU = 0 и Q = A - работа машины равна подведенной извне теплоте. Отсюда можно первое начало термодинамики сформулировать следующим образом: нельзя построить периодически действующую машину, которая совершала бы работу большую, чем количество сообщенной извне энергии. То есть вечный двигатель первого рода невозможен.
Все физические величины, входящие в первое начало термодинамики, могут быть как положительными, так и отрицательными. Если к системе подводится теплота, то dQ > 0, если отводится, то dQ < 0. Если система совершает работу, то dA > 0, если же внешние тела совершают работу над системой, то dA < 0. В качестве примера применения первого начала рассмотрим ряд известных процессов.
|
|
|
1. Изохорный процесс (V = const). dA = pdV = 0, так как dV = 0 из-за V = const, то есть А = 0. Тогда dQ = dU. Если СVмол - молярная теплоемкость при постоянном объеме, то dU = nСVмолdT.
2. Изобарный процесс (p = const). dQ = CРмолndT, где CРмол - молярная теплоемкость при постоянном давлении. С другой стороны dQ = dA + dU, тогда
CРмолndT = dA + nСVмолdT = pdV + nСVмолdT. Из уравнения Клапейрона-Менделеева при p = const следует что pdV = nRdT, тогда CРмолndT = nСVмолdT + nRdT, или CРмол = СVмол + R. Найдем работу A12 = 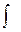 pdV = p(V2 - V1). Так как pdV = nRdT, то A12 = nR(T2 -T1).
pdV = p(V2 - V1). Так как pdV = nRdT, то A12 = nR(T2 -T1).
3. Изотермический процесс (Т = const). dU = 0, так как T = const и dT = 0. Тогда dQ = dA = pdV. При изотермическом процессе внутренняя энергия идеального газа не меняется, поэтому все подводимое тепло идет на совершение работы: dQ = dA = pdV.
4. Адиабатный процесс - процесс, происходящий в системе без теплообмена с внешней средой (dQ = 0). В реальных условиях этот процесс можно провести двумя способами:
а) провести процесс быстро, чтобы теплообмен не успел произойти;
б) изолировать систему от внешней среды.
Тогда: dU + dA = 0 или nСVмолdT = - pdV.
Замечание. При адиабатическом расширении (dV > 0) газ охлаждается, а при адиабатическом сжатии (dV < 0) газ нагревается.
Найдем уравнение адиабатного процесса. Используем уравнение Клапейрона-Менделеева, взяв дифференциал левой и правой частей: pdV + Vdp = nRdT. Из первого начала термодинамики: dT = - pdV/(nСVмол), тогда pdV + Vdp =
= - nRpdV/(nСVмол) или (R/СVмол + 1)pdV + Vdp = (CРмол/СVмол)pdV + Vdp = 0. Разделив на pV, получим (CРмол/СVмол)dV/V + dp/p = 0. Введем обозначение
g = CРмол/СVмол. После интегрирования получим: g lnV + lnp = const. Пропотенцировав это выражение, получим уравнение Пуассона (уравнение адиабаты):
pVg = const.
Используя уравнение Клапейрона-Менделеева, уравнение адиабаты можно записать в других переменных: TV(g-1) = const или Tgp(1-g) = const. На графике в координатах p, V адиабата идет круче, чем изотерма, и спадает более быстро (рис. 4,б).
|
|
|
При изотермическом процессе работа совершается за счет подводимого извне тепла (dT = 0). При адиабатическом процессе первое начало термодинамики имеет вид: dQ = dA + dU = 0, dU = - dA = - pdV = nСVмолdT, тогда работу при адиабатическом процессе можно записать и так:
A12 = 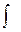 dA = -
dA = - 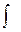 nСVмолdT = -nСVмол (T2 – Т1) = -DU12 = U1 – U2.
nСVмолdT = -nСVмол (T2 – Т1) = -DU12 = U1 – U2.
При адиабатическом процессе система осуществляет работу за счет внутренней энергии.

Рис. 4. Термодинамические процессы: а - изотермический, б - адиабатный
|
|
|


