 |
7.4. Автокатализ с ветвлением, бифуркации – неравновесные фазовые переходы
|
|
|
|
Пример 7. Рассмотрим автокаталитическую реакцию с ветвлением, то есть такая реакция имеет две стадии:
1) A + X ↔ 2X;
2)  .
.
Таким образом, суммарная реакция представляет собой превращение исходного вещества А в конечный продукт В: А ® В, а приток вещества Х отсутствует. Кинетическое уравнение в этом случае имеет вид:
 (7. 21)
(7. 21)
Не решая уравнения, проанализируем систему методом потенциала - н будет, как и в примере 5, содержать квадратичный и кубический члены:
 (7. 22)
(7. 22)
При анализе этого потенциала, в отличие от всех ранее рассмотренных примеров, обнаруживаются два возможных пути протекания процесса. При СА > k2/k1 форма потенциала будет такой, как это показано на рис. 7. 4а: на кривой два экстремума - минимум, отвечающий устойчивому стационарному состоянию при С1= (k1СА-k2)/k-1, и максимум - неустойчивое стационарное состояние при С2=0:

Рис. 7. 4. Потенциал для реакции автокатализа с ветвлением: а -  , б -
, б -  , в -
, в -  .
.
При СА < k2/k1 кривая потенциала рис. 7. 4б сдвинута влево так, что минимум - устойчивое стационарное состояние - расположен теперь при С2=0, а максимум находится в области отрицательных концентраций, т. е не имеет физического смысла.
Переход от одного пути к другому происходит при критической концентрации САкр = k2/k1, когда максимум и минимум сливаются в нуле в одну точку перегиба на рис. 7. 4в. Концентрация СА является критической в том смысле, что по разные стороны от неё кинетическое уравнение системы имеет отличающиеся друг от друга решения: вместо устойчивого стационарного состояния при С = С2 слева от критической точки при СА > CAкр появляется устойчивое состояние при С = С1, а состояние С2 становится неустойчивым - такая критическая точка на языке математики носит название бифуркационной, а особенность разветвления решения при переходе через критическое значение параметра - бифуркацией . Для наглядного изображения возможных состояний системы и их взаимных переходов построим зависимость стационарной концентрации х от СА, которая называется бифуркационной диаграммой (рис. 7. 5):
|
|
|

Рис. 7. 5. Зависимость стационарной концентрации от параметра  (автокатализ с ветвлением): в точке САкр прямая, соответствующая устойчивому стационарному состоянию, которая до этого совпадала с осью абсцисс, скачком меняет наклон - это означает, что устойчивому стационарному состоянию при
(автокатализ с ветвлением): в точке САкр прямая, соответствующая устойчивому стационарному состоянию, которая до этого совпадала с осью абсцисс, скачком меняет наклон - это означает, что устойчивому стационарному состоянию при
СА > САкр соответствует концентрация Сх ¹ 0. Неустойчивое стационарное состояние показано на рисунке пунктиром.
Таким образом, на основе проведённого анализа можно сделать качественные выводы относительно поведения решения модели - зависимости Сх от времени: если СА меньше критического, то концентрация Х будет падать от начального значения до нуля, как показано выще на рисунке а, а при СА > САкр концентрация Х возрастает от начального значения до значения, соответствующего устойчивому стационарному состоянию. В точке САкр, т. е. при переходе через критическое значение параметра, характер поведения системы (путь протекания реакции) меняется скачком - налицо неравновесный фазовый переход. Следовательно, бифуркация решения динамического уравнения модели соответствует неравновесному переходу в системе.
Пример 8. Рассмотрим одну из реакций металлургического производства, которая ведёт себя аналогично системе в примере 7 - такой реакцией является восстановление твёрдого вюстита газообразным оксидом углерода в присутствии твёрдого углерода (в виде кокса или угля):
|
|
|
 .
.
Есть также реакция газификации углерода, которая приводит к увеличению содержания СО:
 .
.
Если реакция газификации протекает быстро (не лимитирует процесс), то эту химическую систему можно представить следующим образом:
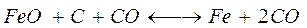 .
.
Учтём дополнительно, что система открыта, т. е. газообразный СО выносится из реакционной зоны со скоростью, пропорциональной его концентрации (пусть коэффициент пропорциональности равен k2). Тогда общая схема процесса запишется в виде:

 .
.
При записи кинетического уравнения этого процесса учтём также, что скорость восстановительной стадии будет зависеть не только от концентрации газообразного СО (которую обозначим как С), но и от размеров реакционной поверхности твёрдых веществ в системе вюстит-углерод, которую обозначим как Sэфф. Тогда скорость изменения концентрации СО будет равна:
 . (7. 23)
. (7. 23)
Полученное уравнение полностью повторяет кинетическое уравнение из примера 7, здесь здесь роль СА играет Sэфф: при Sэфф < k2/k1 реакция затухает (устойчивым является стационарное состояние при нулевой концентрации), при Sэфф > k2/k1 реакция течёт в стационарном режиме, а неравновесный переход происходит при Sэфф = k2/k1, т. е. при определённых размерах реакционных поверхностей вюстита и углерода, которые находятся в твёрдом состоянии.
|
|
|


