 |
3.3. Антиоксидантная система клетки
|
|
|
|
3. 3. Антиоксидантная система клетки
Окислительное фосфорилирование, происходящее в митохондриях, является основным источником АТФ. Активные формы кислорода и азота и углерод- и серосодержащие радикалы являются побочными продуктами этого процесса. В небольших количествах АФК важны для развития и функционирования нейронов, например, они способствуют длительному потенцированию с помощью глутамат-зависимых механизмов (Salim, 2016). Было показано, что активация NR2B способствует генерации супероксид-анион радикала НАДФН-оксидазой через фактор обмена гуаниновых нуклеотидов RasGRF1, что способствует дендритогенезу (Abarzú a et al., 2019).
При нормальных условиях антиоксидантная система клетки нейтрализует АФК, поддерживая их количество на физиологическом уровне. Когда продукция АФК превышает способность антиоксидантной системы устранять их, происходит окисление белка и перекисное окисление липидов, то есть окислительное повреждение клетки (Salim, 2016). Одна из причин тяжелых последствий ишемического инсульта - быстрое увеличение выработки АФК при восстановлении кровообращения, с которыми не справляется антиоксидантная защита клеток (Chouchani et al., 2014). АФК, помимо повреждения макромолекул, участвуют в про- и антиапоптотических сигнальных каскадах и вызывают митохондриальную дисфункцию (Chen et al., 2011). Также АФК запускают различные молекулярные каскады, которые увеличивают проницаемость ГЭБ, вызывают нейровоспаление и гибель нейронов (Gu, 2011). Uzdensky предполагает, что сначала при ишемии глутамат-опосредованный избыток кальция, деполяризация, повреждение митохондрий, генерация АФК и NO активируют ранние сигнальные белки, такие как сенсоры кальция и АФК (например, Са2+/кальмодулин-зависимые белки, HIF-1α ), а затем чувствительные к стрессу протеинкиназы JNK, p38 и другие активируют факторы транскрипции (p53, CREB, NF-κ B) для экспрессии как про-, так и антиапоптотических белков (Uzdensky, 2019).
|
|
|
В мозге существует два вида нейтрализующих АФК механизмов: антиоксидантные ферменты и низкомолекулярные антиоксиданты. Антиоксидантная ферментная система - это такие ферменты, как супероксидидисмутаза (СОД), глиоксалаза, глутатионредуктаза, глутатионпероксидаза и каталаза (Salim, 2016). Цитохром с и р53 играют центральную роль в апоптозе, СОД ингибирует как цитохром с-опосредованный, так и р53-опосредованный пути апоптоза (Chen et al., 2011). Так же Mn-СОД (СОД-2) в матриксе митохондрий нейтрализуют образовавшийся супероксид анион радикал, одновременно с Cu/Zn-СОД (СОД-1), которая считается цитоплазматической изоформой, но также локализуется в межмембранном пространстве митохондрий (Kalogeris et al., 2014). Нейтрализующие функции низкомолекулярных антиоксидантов - глутатиона (GSH), мочевой кислоты, аскорбиновой кислоты и мелатонина - обусловлены хелатированием переходных металлов. GSH может регенерироваться глутатионредуктазой с потреблением НАДФH. Также GSH является кофактором для других ферментов, включая глиоксалазу и пероксидазу (Salim, 2016).
Во время ишемии/реперфузии в мозге образуются NO и O2•- (Chen et al., 2011). NO вызывает нитрозилирование белков, а также образует ONOO- при реакции с O2•-. СОД обезвреживает O2•- до H2O2, которая превращается в H2O с помощью ферментов каталазы или глутатионперокисидазы. OH•, который вырабатывается из H2O2 в ходе реакций Фентона или Хабера-Вейса, вызывает клеточное повреждение за счет окисления липидов, белков, ДНК и РНК (рис. 2).
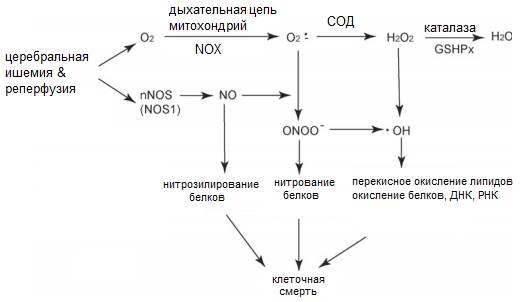
|
| Рисунок 2. Схема генерации АФК при ишемии/реперфузии и действие ферментов антиоксидантной системы клетки (Chen et al., 2011, с изменениями). СОД - супероксиддисмутаза, GSHPx - глутатионпероксидаза, NOX - НАДФН-оксидаза, NOS - NO-синтаза. |
Таким образом, актуален поиск антиоксидантов, которые могут регулировать окислительный стресс за счет повышения эндогенного антиоксидантного потенциала при ишемии/реперфузии головного мозга.
|
|
|
3. 4. Антиапоптотические сигнальные каскады
Рассмотрим наиболее важные антиапоптотические сигнальные каскады, которые запускаются в нейронах зоны ишемической полутени при инсульте в ответ на ишемический стресс.
Транскрипционный фактор Nrf2 в норме локализован в цитоплазме и связан с белком Keap1. Kеар1 вызывает деградацию белка Nrf2. Попадание в клетку АФК приводит к диссоциации Keap1 от Nrf2, и тогда Nrf2 перемещается в ядро, где образует гетеродимер с белком small Maf. Такой гетеродимер способен связываться с участком antioxidant response element (ARE) на ДНК, что вызывает транскрипцию генов, продукты которых противодействуют окислительному стрессу (Oh, Jun, 2017). Например, геном-мишенью этой системы является xCT, кодирующий белок цистин-глутаматного транспортера, который выкачивает глутамат из клетки в обмен на цистин (Habib et al., 2015). Цистин в цитоплазме восстанавливается до цистеина, который нужен для формирования GSH. Другими генами-мишенями этой системы являются гены СОД, глутатионпероксидазы и каталазы (Itoh et al., 1997).
В нейронах также присутствует рецептор фактора роста тромбоцитов (PDGF). Интересно, что при инсульте повышается экспрессия как самого PDGF, так и его рецепторов, причем активация PDGFR-B вызывает более сильный антиапоптотический ответ, чем PDGFR-A, за счет более сильной активации сигнального пути PI3K/Akt, который приводит к выживанию нейронов при повреждениях (Funa, Sasahara, 2013). Автофосфорилирование PDGF может ингибироваться при снижении внутиклеточного GSH (Rigacci et al., 1997), который в нейронах также активирует тирозинкиназу рецептора лейкоцитов (Ltk), формирующую при активации дисульфид-связанные мультимеры (Bauskin et al., 1991). Показано, что Ltk способна связываться с PI3K, за счет чего способствует выживанию нейронов через тот же сигнальный путь (Ueno et al., 1997).
Астроциты при ишемии выделяют фактор роста нервов (NGF) (Jayaraj et al., 2019), который активирует антиапоптотические сигнальные пути при связывании с рецептором TrkA (Kristiansen, Ham, 2014). Например, это может запустить тот же сигнальный путь, PI3K/Akt, через активацию ГТФ-связывающего белка Ras. Последующая активация Akt через PI3K может ингибировать апоптоз путем фосфорилирования проапоптотических белков, таким образом инактивируя их, например, фосфорилируются белок Bad и фактор транскрипции FOXO, который вызывает экспрессию проапоптотического белка Bim. Также связывание NGF с его рецептором TrkA может активировать сигнальный путь Raf-MEK-ERK (рис. 3). Этот путь способствует выживанию путем подавления экспрессии Bim и активации киназы Rsk, которая фосфорилирует и активирует фактор транскрипции CREB, активирующий в свою очередь экспрессию генов антиапоптотических белков Bcl-2 и Bcl-xL (Kristiansen, Ham, 2014). Также фактор транскрипции CREB может фосфорилироваться РКА (Wang et al., 2019).
|
|
|

|
| Рисунок 3. Каскады, запускающиеся вследствие связывания NGF с TrkA (Kristiansen, Ham, 2014, с изменениями). |
Однако лишь недолговременная активация ERK1/2 сигнального пути способствует выживанию нейронов, в то время как длительная активация ERK1/2 способствует апоптозу. Согласно исследованию Gao et al. в модели фокальной ишемии головного мозга, индуцированной окклюзией среднемозговой артерии (МСАО) у крыс повышается уровень экспрессии фосфорилированной формы ERK1/2, а ингибитор этого фермента снижает как его активацию, так и количество погибших нейронов в мозге, и авторы делают вывод, что активация ERK1/2 сигнального пути приводит к апоптозу нейронов (Gao et al., 2019). Также Vartiainen et al. показали, что ацетилсалициловая кислота способствует выживанию нейронов, ингибируя устойчивую активацию ERK1/2 (Vartiainen et al., 2003).
Белок Bcl-2 контролирует уровень митохондриальных АФК как при нормальных, так и при патологических условиях. В нормальных условиях этот белок взаимодействует с Rac1 и цитохром с оксидазой в митохондрии и имеет прооксидантную активность для поддержания физиологического уровня АФК, необходимого для передачи клеточных сигналов. В условиях окислительного стресса взаимодействие между Bcl-2 и цитохром с оксидазой снижается, что обуславливает антиоксидантное действие Bcl-2, а также он способствует митохондриальной локализации низкомолекулярного антиоксиданта GSH (Chong et al., 2014).
Белок Bcl-x локализуется во внешней мембране митохондрий и имеет две противоположных по действию изоформы, появляющиеся в результате альтернативного сплайсинга: длинная антиапоптотическая изоформа Bcl-xL и короткая проапоптотическая изоформа Bcl-xS. Изоформа Bcl-xL более распространена и проявляет антиапоптотическое действие путем ингибирования проапоптотического белка Bax (Stevens, Oltean, 2019).
|
|
|


