|
6.2. Влияние салицил-карнозина на активацию киназ Akt, ERK1/2, JNK и относительное количество про- и антиапоптотических белков в первичной культуре клеток коры больших полушарий мозга крыс в условиях глюкозо-кислородной депривации
|
|
|
|
6. 2. Влияние салицил-карнозина на активацию киназ Akt, ERK1/2, JNK и относительное количество про- и антиапоптотических белков в первичной культуре клеток коры больших полушарий мозга крыс в условиях глюкозо-кислородной депривации
Чтобы оценить влияние салицил-карнозина на активацию киназ Akt, ERK1/2, JNK, а также относительное количество про- и антиапоптотических белков в условиях ГКД с реоксигенацией, была проведена 4-часовая ГКД с 1-часовой реоксигенацией для выявления кратковременных эффектов салицил-карнозина, а также ГКД с 6-часовой реоксигенацией для выявления долговременных эффектов салицил-карнозина. Анализ полученных проб проводили при помощи вестерн-блоттинга. Активацию киназ Akt, ERK1/2, JNK рассчитывали по соотношению интенсивности люминесценции полос, соответствующих их фосфорилированной форме, к интенсивности люминесценции полос, соответствующих их общему количеству в пробе, нормированных на общее количество белка в соответствующих дорожках на мембране. Также рассчитывали относительное количество фосфорилированной формы протеинкиназы Сγ, транскрипционного фактора Nrf2, проапоптотического белка Bak и антиапоптотических белков Bcl-2, Bcl-xL по соотношению интенсивности люминесценции соответствующих им полос к общему количеству белка в соответствующих дорожках на мембране.
Киназа Akt участвует в антиапоптотическом сигнальном каскаде PI3K/Akt, способствуя выживанию клеток. Для изучения влияния ГКД и СК на активацию, общее количество и количество фосфорилированной формы киназы Akt проводили 4-часовую ГКД с 1- или 6-часовой реоксигенацией. При помощи вестерн-блоттинга анализировали общее количество киназы Akt и ее фосфорилированной формы, а также общее количество белка на мембране для нормировки. tAkt - общее количество киназы Akt, нормированное на общее количество белка в соответствующей дорожке на мембране, pAkt - количество фосфорилированной формы киназы Akt, нормированное на общее количество белка в соответствующей дорожке на мембране, pAkt/tAkt - активация киназы Akt.
|
|
|
Таблица 5. Активация киназы Akt, рассчитанная по соотношению интенсивности люминесценции полос фосфорилированной формы к общему количеству Akt (p/tAkt), общее количество Akt (tAkt) и количество фосфорилированной формы (pAkt), нормированные на общее количество белка в соответствующих дорожках на мембране, в культурах при инкубации с салицил-карнозином во время ГКД и реоксигенации (ГКД+1мМ СК (ГКД+Р) или только во время реоксигенации (ГКД+1мМ СК (Р) относительно культуры, не подвергавшейся ГКД (ИЦСЖ, принята за 100%). ИЦСЖ - искусственная цереброспинальная жидкость, ГКД - глюкозо-кислородная депривация, СК - салицил-карнозин, Р - реоксигенация. В таблице представлено среднее ± стандартное отклонение, n=6.
|
| ИЦСЖ | ГКД | ГКД+1мМ СК (ГКД+Р) | ГКД+1мМ СК (Р) | |
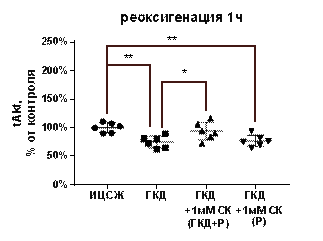
| Реоксигенация 1 час | p/tAkt, % | 100±26, 49 | 33, 83±6, 48 | 30, 2±4, 71 | 39, 89±11, 15 |
| tAkt, % | 100±8, 62 | 74, 83±10, 48 | 94±15, 68 | 76, 61±10, 21 | |
| pAkt, % | 100±25, 28 | 25, 38±5, 54 | 28, 76±7, 95 | 31, 08±11, 53 | |
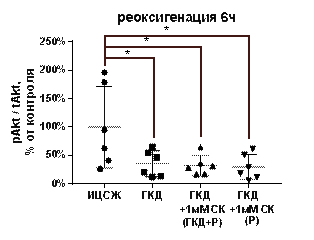
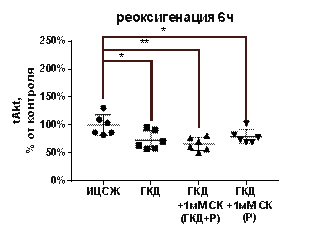
| Реоксигенация 6 часов | p/tAkt, % | 100±71, 93 | 35, 44±22, 84 | 32, 81±17, 59 | 29, 54±22, 29 |
| tAkt, % | 100±18, 52 | 72, 71±16, 88 | 66, 07±11, 86 | 79, 09±12, 65 | |
| pAkt, % | 100±83, 47 | 23, 99±15, 94 | 21, 53±13, 8 | 22, 89±18, 26 | |
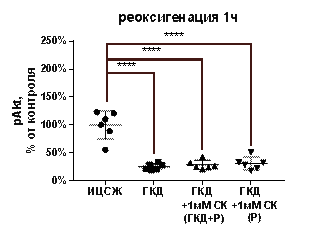
В культурах, инкубированных в условиях ГКД с последующей 1-часовой реоксигенацией, выявили снижение pAkt/tAkt на 66, 17% (р< 0, 0001), снижение tAkt на 25, 17% (р=0, 0036) и снижение pAkt на 74, 62% (р< 0, 0001) по сравнению с культурой, инкубированной в ИЦСЖ в условиях нормоксии (табл. 5, рис. 12, А-В).
1 мМ СК при инкубации с ним культуры во время ГКД и 1-часовой реоксигенации не влиял на pAkt/tAkt и pAkt относительно культуры, инкубированной в условиях ГКД и во время 1-часовой реоксигенации без вещества. Эти параметры также снизились относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии, на 69, 8% (р< 0, 0001) и на 71, 24% (р< 0, 0001) соответственно (рис. 12, А-В). 1 мМ СК при инкубации с ним культуры во время ГКД и 1-часовой реоксигенации приводил к увеличению tAkt относительно культуры, инкубированной в условиях ГКД и во время 1-часовой реоксигенации без вещества, на 19, 17% (р=0, 0339). Также культура, инкубированная с 1 мМ СК во время ГКД и 1-часовой реоксигенации не имела отличий от культуры, инкубированной в ИЦСЖ в условиях нормоксии по этому параметру (рис. 12, Б).
|
|
|
1 мМ СК при инкубации с ним культуры только во время 1-часовой реоксигенации не влиял на pAkt/tAkt, tAkt, pAkt относительно культуры, инкубированной в условиях ГКД и 1-часовой реоксигенации без вещества. Эти параметры снижались относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии, на 60, 11% (p< 0, 0001), 23, 39% (р=0, 0044) и 68, 92% (р< 0, 0001) соответственно (рис. 12, А-В).
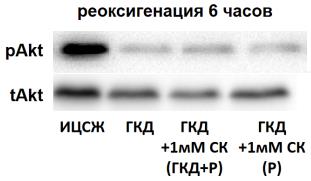
При 6-часовой реоксигенации после ГКД pAkt/tAkt, tAkt, pAkt снижались относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии, на 64, 56% (р=0, 0198), 27, 2% (р=0, 0112) и 76, 01% (р=0, 0173) соответственно (рис. 12, Д-Ж).
1 мМ СК при инкубации культуры с ним во время ГКД и 6-часовой реоксигенации не влиял на pAkt/tAkt, tAkt, pAkt относительно культуры, инкубированной в условиях ГКД и 6-часовой реоксигенации без вещества. Эти параметры также снизились на 67, 19% (р=0, 0198), 33, 93% (р=0, 0029) и 78, 47% (р=0, 0173) соответственно относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии (рис. 12, Д-Ж).
1 мМ СК при инкубации культуры с ним только во время 6-часовой реоксигенации также не влиял на pAkt/tAkt, tAkt, pAkt относительно культуры, инкубированной в условиях ГКД и 6-часовой реоксигенации без вещества. Эти параметры снизились на 70, 46% (р=0, 0198), 20, 93% (р=0, 0275) и 77, 11% (р=0, 0173) соответственно относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии (рис. 12, Д-Ж).
 А А
|  Д Д
| ||
 Б Б
|  Е Е
| ||
 В В
|  Ж Ж
| ||
 Г Г
|  З
З
| ||
| Рисунок 12. Влияние 1 мМ салицил-карнозина на активацию киназы Akt в первичной культуре нейронов при инкубации с ним во время ГКД и реоксигенации или только во время реоксигенации. Культуры инкубировали в ИЦСЖ в условиях нормоксии («ИЦСЖ») или в ИЦСЖ без глюкозы в условиях гипоксии в течение 4 часов без добавления 1 мМ салицил-карнозина («ГКД») или с его добавлением во время ГКД и реоксигенации («ГКД+1мМ СК (ГКД+Р)») или только во время реоксигенации («ГКД+1мМ СК (Р)»). pAkt - количество фосфорилированной формы киназы Akt, нормированное на общее количество белка в соответствующей дорожке на мембране, tAkt - общее количество киназы Akt, нормированное на общее количество белка в соответствующей дорожке на мембране. Для проверки нормальности распределений использовали тест Шапиро-Уилка. Для определения достоверности различий использовали однофакторный дисперсионный анализ. На графиках представлено среднее ± стандартное отклонение, n=6. * - p< 0, 05, ** - p< 0, 01, *** - p< 0, 001, **** - p< 0, 0001.
| |||
Согласно данным из литературы, 4-часовая ГКД с последующей 24-часовой реоксигенацией вызывает снижение pAkt и не влияет на tAkt, что было показано на клеточной линии РС12. Добавление нобилетина проиводействовало снижению pAkt (Li et al., 2018). В модели ишемии in vivo показали, что tAkt не меняется под действием ишемии относительно ложнооперированных крыс, а pAkt и pAkt/tAkt снижаются (Zhao et al., 2020). Также в литературе встречаются данные, свидетельствующие о снижении tAkt при ишемии in vivo (Gao et al., 2010; Wei et al., 2021). Согласно полученным данным, ГКД вызывает снижение pAkt, tAkt и pAkt/tAkt, что согласуется с данными литературы.
Салицил-карнозин оказывает воздействие только при инкубации с ним во время ГКД и 1-часовой реоксигенации, и его нейротротекторное действие, согласно полученным данным, может быть связано с увеличением tAkt. Однако в литературе есть данные, свидетельствующие о том, что действие нейропротекторных веществ, влияющих на Akt, связано с увеличением фосфорилированной формы этого фермента. Например, добавление артесуната снижает повреждение, вызванное ГКД, за счет увеличения pAkt (Zhang et al., 2020).
В условиях ГКД с последующей 6-часовой реоксигенацией pAkt/tAkt, tAkt и pAkt также снижаются. Это обусловлено влиянием самой ГКД, но не салицил-карнозина.
Таким образом, на основании полученных данных можно сделать вывод о том, что нейропротекторное действие салицил-карнозин в концентрации 1 мМ при инкубации с ним культуры во время ГКД и 1-часовой реоксигенации может быть связано с увеличением общего количества киназы Akt.
|
|
|
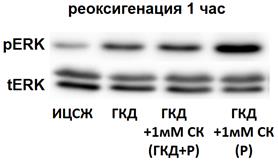
В регуляции жизнеспособности нейронов также участвует киназа ERK1/2 (Kristiansen, Ham, 2014). Для изучения влияния ГКД и салицил-карнозина на активацию, общее количество и количество фосфорилированной формы киназы ERK1/2 проводили 4-часовую ГКД с 1- или 6-часовой реоксигенацией. При помощи вестерн-блоттинга анализировали общее количество киназы ERK1/2 и ее фосфорилированной формы, а также общее количество белка на мембране для нормировки. tERK1/2 - общее количество киназы ERK1/2, нормированное на общее количество белка в соответствующей дорожке на мембране, pERK1/2 - количество фосфорилированной формы киназы ERK1/2, нормированное на общее количество белка в соответствующей дорожке на мембране, pERK1/2/tERK1/2 - активация киназы ERK1/2.
Таблица 6. Активация киназы ERK1/2, рассчитанная по соотношению интенсивности люминесценции полос фосфорилированной формы к общему количеству ERK1/2 (p/tERK1/2), общее количество ERK1/2 (tERK1/2) и количество фосфорилированной формы (pERK1/2), нормированные на общее количество белка в соответствующих дорожках на мембране, в культурах при инкубации с салицил-карнозином во время ГКД и реоксигенации (ГКД+1мМ СК (ГКД+Р) или только во время реоксигенации (ГКД+1мМ СК (Р) относительно культуры, не подвергавшейся ГКД (ИЦСЖ, принята за 100%). ИЦСЖ - искусственная цереброспинальная жидкость, ГКД - глюкозо-кислородная депривация, СК - салицил-карнозин, Р - реоксигенация. В таблице представлено среднее ± стандартное отклонение, n=6.
|
| ИЦСЖ | ГКД | ГКД+1мМ СК (ГКД+Р) | ГКД+1мМ СК (Р) | |
| Реоксигенация 1 час | p/tERK1/2, % | 100±40, 26 | 291, 4±118, 9 | 329, 7±119 | 583, 4±311, 8 |
| tERK1/2, % | 100±70, 55 | 88, 09±59, 37 | 93, 56±57, 02 | 97, 25±46, 98 | |
| pERK1/2, % | 100±45, 94 | 225, 6±62, 96 | 285, 3±85, 28 | 487, 4±246, 1 | |
| Реоксигенация 6 часов | p/tERK1/2, % | 100±40, 66 | 345, 4±140 | 280, 9±142, 1 | 209, 5±126 |
| tERK1/2, % | 100±12, 13 | 68, 93±9, 59 | 72, 16±14, 06 | 76, 9±19, 9 | |
| pERK1/2, % | 100±37, 77 | 236, 7±76, 06 | 198, 6±84, 95 | 157, 2±86, 05 | |
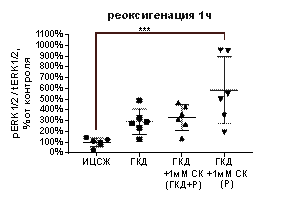
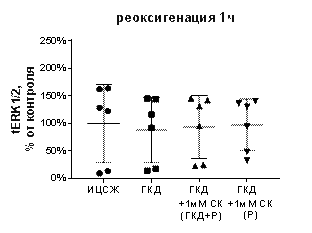
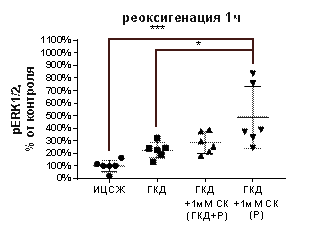
В культурах, инкубированных в условиях ГКД с последующей 1-часовой реоксигенацией без вещества, а также в культуре, инкубированной с 1 мМ СК во время ГКД и 1-часовой реоксигенации, не было выявлено отличий от культуры, инкубированной в ИЦСЖ в условиях нормоксии по таким параметрам, как tERK1/2, pERK1/2 и pERK1/2 / tERK1/2 (табл. 6, рис. 13, А-В).
1 мМ СК при инкубации с ним культуры только во время 1-часовой реоксигенации вызывал увеличение pERK1/2 / tERK1/2 на 483, 4% (р=0, 0004) по сравнению с культурой, инкубированной в ИЦСЖ в условиях нормоксии (рис. 13, А), а также вызывал увеличение pERK1/2 на 387, 4% (р=0, 0002) относительной культуры, инкубированной в ИЦСЖ в условиях нормоксии, и на 261, 8% (р=0, 0206) относительно культуры, инкубированной в условиях ГКД без вещества (рис. 13, В), но не повлияла на tERK1/2 (рис. 13, Б).
|
|
|
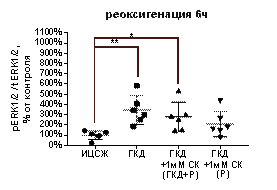
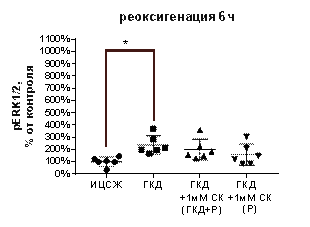
При инкубации культуры в условиях ГКД с последующей 6-часовой реоксигенацией выявили увеличение pERK1/2 / tERK1/2 на 245, 4% (р=0, 006) и увеличение pERK1/2 на 136, 7% (р=0, 0133), а также снижение tERK1/2 на 31, 07% (р=0, 004) относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии (рис. 13, Д-Ж).
1 мМ СК при инкубации с ним культуры во время ГКД и 6-часовой реоксигенации вызывал увеличение pERK1/2 / tERK1/2 на 180, 9% (р=0, 0327) и снижение tERK1/2 на 27, 84% (р=0, 0065) относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии, в то время как количество pERK1/2 не менялось (рис. 13, Д-Ж).
1 мМ СК при инкубации с ним культуры только во время 6-часовой реоксигенации вызывал снижение tERK1/2 на 23, 1% (р=0, 0117), в то время как pERK1/2 / tERK1/2 и pERK1/2 не менялись относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии (рис. 13, Д-Ж).
 А
А
|  Д
Д
|
 Б Б
|  Е Е
|
 В В
|  Ж Ж
|
 Г
Г
|  З
З
|
| Рисунок 13. Влияние 1 мМ салицил-карнозина на активацию киназы ERK1/2 в первичной культуре нейронов при инкубации с ним во время ГКД и реоксигенации или только во время реоксигенации. Культуры инкубировали в ИЦСЖ в условиях нормоксии («ИЦСЖ») или в ИЦСЖ без глюкозы в условиях гипоксии в течение 4 часов без добавления 1 мМ салицил-карнозина («ГКД») или с его добавлением во время ГКД и реоксигенации («ГКД+1мМ СК (ГКД+Р)») или только во время реоксигенации («ГКД+1мМ СК (Р)»). pERK1/2 - количество фосфорилированной формы киназы ERK1/2, нормированное на общее количества белка в соответствующей дорожке на мембране, tERK1/2 - общее количество киназы ERK1/2, нормированное на общее количества белка в соответствующей дорожке на мембране. Для проверки нормальности распределений использовали тест Шапиро-Уилка. Для определения достоверности различий использовали однофакторный дисперсионный анализ. На графиках представлено среднее ± стандартное отклонение, n=6. * - p< 0, 05, ** - p< 0, 01, *** - p< 0, 001, **** - p< 0, 0001. | |
Согласно данным литературы, 4-часовая ГКД с последующей 2-часовой реоксигенацией и 1-часовая ГКД с последующей 24-часовой реоксигенацией вызывает увеличение количества pERK1/2, при этом tERK1/2 не меняется (Liu et al., 2018; Si et al., 2019). Согласно полученным данным после 1-часовой реоксигенации tERK1/2 также не меняется, но снижается при 6-часовой реоксигенации. Также после 1-часовой реоксигенации pERK1/2 не меняется, а после 6-часовой реоксигенации увеличивается, что согласуется с данными литературы.
Также полученные данные совпадают с данными из литературы, согласно которым устойчивая активация ERK1/2 происходит во время реоксигенации, причем эта активация ингибируется ацетилсалициловой кислотой, чем и объясняется ее нейропротекторный эффект (Vartiainen et al., 2013). Таким образом, согласно полученным данным, добавление 1 мМ салицил-карнозина при 1-часовой реоксигенации может оказывать нейропротекторное действие за счет активации киназы ERK1/2 (увеличения количества ее фосфорилированной формы), а при 6-часовой реоксигенации - за счет того, что вызывает уменьшение ее активации при ишемии.
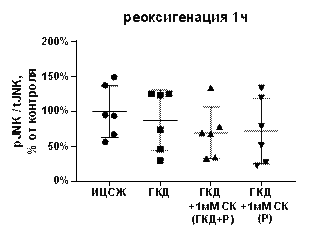
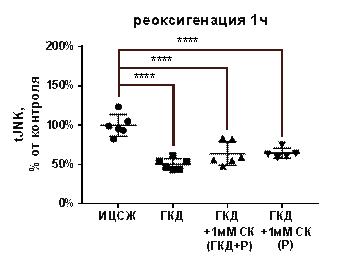
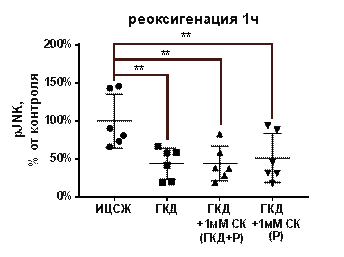
Киназа JNK участвует в проапоптотических сигнальных каскадах (Kristiansen, Ham, 2014). Для изучения влияния ГКД и салицил-карнозина на активацию, общее количество и количество фосфорилированной формы киназы JNK проводили 4-часовую ГКД с 1-часовой реоксигенацией. При помощи вестерн-блоттинга анализировали общее количество киназы JNK и ее фосфорилированной формы, а также общее количество белка в соответствующих дорожках на мембране для нормировки. tJNK - общее количество киназы JNK, нормированное на общее количество белка в соответствующей дорожке на мембране, pJNK - количество фосфорилированной формы киназы JNK, нормированное на общее количество белка в соответствующей дорожке на мембране, pJNK/tJNK - активация киназы JNK.
Таблица 7. Активация киназы JNK, рассчитанная по соотношению интенсивности люминесценции полос фосфорилированной формы к общему количеству JNK (p/tJNK), общее количество JNK (tJNK) и количество фосфорилированной формы (pJNK), нормированные на общее количество белка в соответствующих дорожках на мембране, в культурах при инкубации с салицил-карнозином во время ГКД и реоксигенации (ГКД+1мМ СК (ГКД+Р) или только во время реоксигенации (ГКД+1мМ СК (Р) относительно культуры, не подвергавшейся ГКД (ИЦСЖ, принята за 100%). ИЦСЖ - искусственная цереброспинальная жидкость, ГКД - глюкозо-кислородная депривация, СК - салицил-карнозин, Р - реоксигенация. В таблице представлено среднее ± стандартное отклонение, n=6.
| ИЦСЖ | ГКД | ГКД+1мМ СК (ГКД+Р) | ГКД+1мМ СК (Р) | |
| Реоксигенация 1 час, p/tJNK, % | 100±36, 95 | 87, 42±43, 3 | 69, 56±37, 02 | 72, 27±46, 84 |
| Реоксигенация 1 час, tJNK, % | 100±13, 78 | 50, 72±6, 89 | 63, 98±15, 05 | 64, 55±6, 31 |
| Реоксигенация 1 час, pJNK, % | 100±35, 5 | 43, 95±20, 59 | 44, 03±23, 07 | 51, 29±32, 23 |
В культуре, инкубированной в условиях ГКД с последующей 1-часовой реоксигенацией без вещества, снизилось как tJNK на 49, 28% (p< 0, 0001), так и pJNK на 56, 05% (p=0, 0084) по сравнению с культурой, инкубированной в ИЦСЖ в условиях нормоксии. Соотношение pJNK/tJNK при инкубации культуры в условиях ГКД с последующей 1-часовой реоксигенацией без вещества не изменялось (табл. 7, рис. 14, А-В).
1 мМ СК при инкубации с ним культуры как во время ГКД и 1-часовой реоксигенации, так и только во время 1-часовой реоксигенации не повлиял на эти параметры: tJNK осталось сниженным на 36, 02% (p< 0, 0001) и на 35, 45% (p=0, 0084) соответственно относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии; pJNK осталось сниженным на 55, 98% (p< 0, 0001) и на 48, 71 (р=0, 0084) соответственно относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии. pJNK/tJNK как при инкубации с 1 мМ СК во время ГКД и 1-часовой реоксигенации, так и только во время 1-часовой реоксигенации также не отличался от pJNK/tJNK в культуре, инкубированной в ИЦСЖ в условиях нормоксии, и от pJNK/tJNK в культуре, инкубированной в условиях ГКД с последующей 1-часовой реоксигенацией без вещества (рис. 14, А-В).
 А А
|  Б Б
|
 В В
|  Г
Г
|
| Рисунок 14. Влияние 1 мМ салицил-карнозина на активацию киназы JNK в первичной культуре нейронов при инкубации с ним во время ГКД и реоксигенации или только во время реоксигенации. Культуры инкубировали в ИЦСЖ в условиях нормоксии («ИЦСЖ») или в ИЦСЖ без глюкозы в условиях гипоксии в течение 4 часов без добавления 1 мМ салицил-карнозина («ГКД») или с его добавлением во время ГКД и реоксигенации («ГКД+1мМ СК (ГКД+Р)») или только во время реоксигенации («ГКД+1мМ СК (Р)»). pJNK - количество фосфорилированной формы киназы JNK, нормированное на общее количество белка в соответствующей дорожке на мембране, tJNK - общее количество киназы JNK, нормированное на общее количество белка в соответствующей дорожке на мембране. Для проверки нормальности распределений использовали тест Шапиро-Уилка. Для определения достоверности различий использовали однофакторный дисперсионный анализ. На графиках представлено среднее ± стандартное отклонение, n=6. * - p< 0, 05, ** - p< 0, 01, *** - p< 0, 001, **** - p< 0, 0001. | |
Согласно данным литературы, сигнальный путь, в котором участвует киназа JNK, вызывает апоптоз нейронов. Активность JNK растет при ишемии в мозге крыс, а вещества, способствующие ингибированию этого пути, проявляют нейропротекторный эффект (Zhou L. et al., 2019; Chang et al., 2020). Согласно полученным данным, ГКД вызывает снижение как tJNK, так и pJNK, но не влияет на их соотношение. Инкубация культуры с 1 мМ СК как во время ГКД и 1-часовой реоксигенации, так и только во время 1-часовой реоксигенации не повлияла на активацию фермента JNK, то есть нейропротекторное действие салицил-карнозина не обусловлено его влиянием на проапоптотическую киназу JNK.
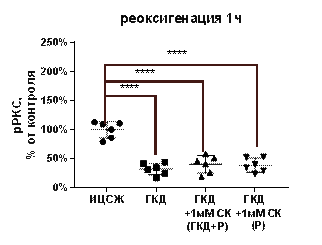
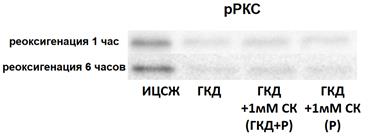
PKCγ, активная в фосфорилированной форме, принимает участие в регуляции жизнеспособности нейронов. Для изучения влияния ГКД и салицил-карнозина на количество фосфорилированной формы PKCγ проводили 4-часовую ГКД с 1- или 6-часовой реоксигенацией. При помощи вестерн-блоттинга анализировали количество фосфорилированной формы киназы PKCγ, а также общее количество белка на мембране для нормировки. pJNK - количество фосфорилированной формы киназы PKCγ, нормированное на общее количество белка в соответствующих дорожках на мембране.
Таблица 8. Количество фосфорилированной формы PKCγ (pPKCγ ), нормированное на общее количество белка в соответствующих дорожках на мембране, в культурах при инкубации с салицил-карнозином во время ГКД и реоксигенации (ГКД+1мМ СК (ГКД+Р) или только во время реоксигенации (ГКД+1мМ СК (Р) относительно культуры, не подвергавшейся ГКД (ИЦСЖ, принята за 100%). ИЦСЖ - искусственная цереброспинальная жидкость, ГКД - глюкозо-кислородная депривация, СК - салицил-карнозин, Р - реоксигенация. В таблице представлено среднее ± стандартное отклонение, n=6.
| ИЦСЖ | ГКД | ГКД+1мМ СК (ГКД+Р) | ГКД+1мМ СК (Р) | |
| Реоксигенация 1 час, pPKCγ, % | 100±14, 18 | 32, 27±10, 04 | 40, 39±15, 05 | 38, 9±12, 17 |
| Реоксигенация 6 часов, pPKCγ, % | 100±51, 77 | 26, 52±10, 69 | 16, 58±9, 46 | 24, 5±12, 94 |
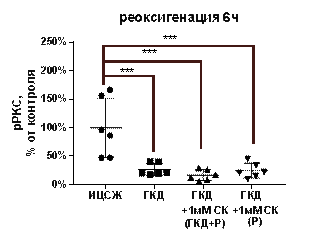
По сравнению с культурой, инкубированной в ИЦСЖ в условиях нормоксии, pPKCγ в культурах, инкубированных в условиях ГКД, снижается на 67, 73% (р< 0, 0001) за 1 час после начала реоксигенации и на 73, 48% (р=0, 0003) за 6 часов после начала реоксигенации (табл. 8, рис. 15, А).
1 мМ СК при инкубации с ним культуры как во время ГКД и 1-часовой реоксигенации, так и только во время 1-часовой реоксигенации не повлиял на pPKCγ: этот параметр остался сниженным на 59, 61% (р< 0, 0001) и на 61, 1% (р< 0, 0001) соответственно относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии (рис. 15, А).
1 мМ СК при инкубации с ним культуры как во время ГКД и 6-часовой реоксигенации, так и только во время 6-часовой реоксигенации также не повлиял на pPKCγ: этот параметр остался сниженным на 83, 42% (р=0, 0001) и на 75, 5% (р=0, 0003) соответственно относительно культуры, инкубированной в ИЦСЖ в условиях нормоксии (рис. 15, Б).
 А А
|  Б Б
|
|
В | |
| Рисунок 15. Влияние 1 мМ салицил-карнозина на количество фосфорилированной формы PKCγ (pPKC) в первичной культуре нейронов при инкубации с ним во время ГКД и реоксигенации или только во время реоксигенации. Культуры инкубировали в ИЦСЖ в условиях нормоксии («ИЦСЖ») или в ИЦСЖ без глюкозы в условиях гипоксии в течение 4 часов без добавления 1 мМ салицил-карнозина («ГКД») или с его добавлением во время ГКД и реоксигенации («ГКД+1мМ СК (ГКД+Р)») или только во время реоксигенации («ГКД+1мМ СК (Р)»). Для проверки нормальности распределений использовали тест Шапиро-Уилка. Для определения достоверности различий использовали однофакторный дисперсионный анализ. На графиках представлено среднее ± стандартное отклонение, n=6. * - p< 0, 05, ** - p< 0, 01, *** - p< 0, 001, **** - p< 0, 0001. | |
Согласно данным литературы, при ГКД наблюдается ранняя активация PKCε (15-минутная ГКД) и отсроченная активация PKCγ (30-минутная ГКД), что свидетельствует об их роли в ответ на разные длительность и стадии ишемического стресса (Surendran, 2019). После 15-минутной ГКД с последующей 1-часовой рекосигенацией в нейронах коры головного мозга крыс снижалось количество изоформ РКС α, β 1, β 2, γ; количество изоформ δ и ζ не менялось, а количество изоформы ε увеличилось (Selvatici et al., 2002). Полученные данные согласуются с данными литературы: количество РКСγ снижается при 1- и 6-часовой реоксигенации.
РКСζ оказывает нейропротекторное действие, например, фосфорилирует прокаспазу-9, таким образом инактивируя ее (Shakeri et al., 2017), но в то же время фосфорилирует субъединицу p47phox NOX, активируя фермент, способный генерировать АФК (Chen et al., 2011). Снижение активации РКСγ может быть обусловлено защитными механизмами клетки. Салицил-карнозин остается перспективным препаратом для устранения последствий ишемического инсульта, так как не влияет на количество рРКСγ в культуре нейронов.
Транскрипционный фактор Nrf2 запускает экспрессию генов, продукты которых способствуют снижению уровня окислительного стресса в клетке (Oh, Jun, 2017). Для изучения влияния ГКД и салицил-карнозина на общее количество Nrf2 проводили 4-часовую ГКД с 6-часовой реоксигенацией и вестерн-блоттинг, полученные мембраны окрашивали при помощи антител на общее количество Nrf2 и на общее количество белка на мембране для нормировки.
Таблица 9. Количество белка Nrf2, нормированное на общее количество белка в соответствующих дорожках на мембране, в культурах при инкубации с салицил-карнозином во время ГКД и реоксигенации (ГКД+1мМ СК (ГКД+Р) или только во время реоксигенации (ГКД+1мМ СК (Р) относительно культуры, не подвергавшейся ГКД (ИЦСЖ, принята за 100%). ИЦСЖ - искусственная цереброспинальная жидкость, ГКД - глюкозо-кислородная депривация, СК - салицил-карнозин, Р - реоксигенация. В таблице представлено среднее ± стандартное отклонение, n=6.
| ИЦСЖ | ГКД | ГКД+1мМ СК (ГКД+Р) | ГКД+1мМ СК (Р) | |
| Реоксигенация 1 час, Nrf2, % | 100±41, 28 | 122±48, 77 | 91, 76±32, 08 | 92, 39±27, 16 |
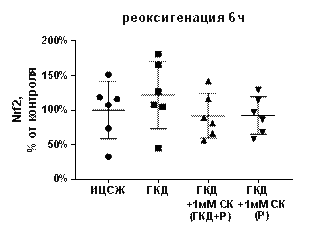
Относительное количество антиапоптотического белка Nrf2 не меняется как в условиях ГКД, так и при добавлении к культуре нейронов 1 мМ салицил-карнозина (табл. 9, рис. 16, А).
 А
А
|  Б Б
|
| Рисунок 16. Влияние 1 мМ салицил-карнозина на количество белка Nrf2 в первичной культуре нейронов при инкубации с ним во время ГКД и реоксигенации или только во время реоксигенации. Культуры инкубировали в ИЦСЖ в условиях нормоксии («ИЦСЖ») или в ИЦСЖ без глюкозы в условиях гипоксии в течение 4 часов без добавления 1 мМ салицил-карнозина («ГКД») или с его добавлением во время ГКД и реоксигенации («ГКД+1мМ СК (ГКД+Р)») или только во время реоксигенации («ГКД+1мМ СК (Р)»). Для проверки нормальности распределений использовали тест Шапиро-Уилка. Для определения достоверности различий использовали однофакторный дисперсионный анализ. На графиках представлено среднее ± стандартное отклонение, n=6. * - p< 0, 05, ** - p< 0, 01, *** - p< 0, 001, **** - p< 0, 0001. | |
Согласно данным литературы, количество Nrf2 увеличивается при 4-часовой ГКД с 24-часовой реоксигенацией (Zhi et al., 2020). Nrf2 является транскрипционным фактором, способствующим экспрессии генов, продукты которых снижают уровень окислительного стресса (Oh, Jun, 2017). Согласно полученным данным количество Nrf2 не меняется в данной модели как под влиянием ГКД, так и при добавлении салицил-канозина. То есть, нейропротекторный эффект салицил-карнозина не связан с Nrf2.
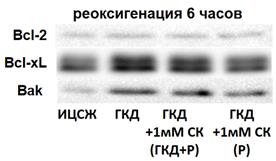
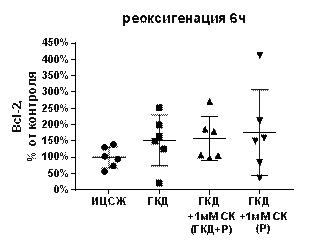
Белки семейства Bcl-2 выполняют как проапототическую, так и антиапоптотическую функцию. Для изучения влияния ГКД и салицил-карнозина на количество белков семейства Bcl-2 проводили 4-часовую ГКД с 6-часовой реоксигенацией и вестерн-блоттинг, полученные мембраны окрашивали при помощи антител на общее количество белков семейства Bcl-2 (Bcl-2, Bcl-xL, Bak) и на общее количество белка на мембране для нормировки.
Таблица 10. Количество белков семейства Bcl-2 (Bcl-2, Bcl-xL, Bak), нормированное на общее количество белка в соответствующих дорожках на мембране, в культурах при инкубации с салицил-карнозином во время ГКД и реоксигенации (ГКД+1мМ СК (ГКД+Р) или только во время реоксигенации (ГКД+1мМ СК (Р) относительно культуры, не подвергавшейся ГКД (ИЦСЖ, принята за 100%). ИЦСЖ - искусственная цереброспинальная жидкость, ГКД - глюкозо-кислородная депривация, СК - салицил-карнозин, Р - реоксигенация. В таблице представлено среднее ± стандартное отклонение, n=6.
| ИЦСЖ | ГКД | ГКД+1мМ СК (ГКД+Р) | ГКД+1мМ СК (Р) | |
| Реоксигенация 6 часов, Bcl-2, % | 100±32, 01 | 152, 2±77, 52 | 157, 8±67, 5 | 176, 2±131, 3 |
| ИЦСЖ | ГКД | ГКД+1мМ СК (ГКД+Р) | ГКД+1мМ СК (Р) | |
| Реоксигенация 6 часов, Bcl-xL, % | 100±23, 54 | 151, 5±32, 04 | 128, 9±16 | 125, 1±33 |
| Реоксигенация 6 часов, Bak, % | 100±43, 77 | 277, 2±155, 6 | 157, 5±111, 3 | 213, 7±72, 9 |
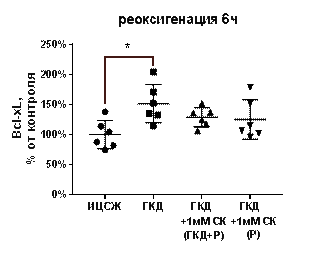
Относительное количество антиапоптотического белка Bcl-2 не меняется как в условиях ГКД, так и при добавлении к культуре нейронов 1 мМ СК (табл. 10, рис. 17, А).
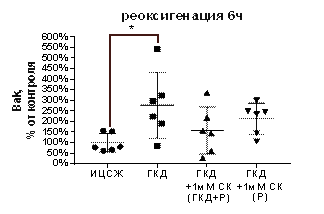
В культурах, инкубированных в условиях ГКД без добавления вещества с последующей 6-часовой рекосигенацией, выявили увеличение относительного количества как проапоптотического белка Bak, так и антиапоптотического белка Bcl-xL по сравнению с культурой, инкубированной в ИЦСЖ в условиях нормоксии (рис. 17, Б, В). Однако стоит отметить, что количество проапоптотического белка Bak увеличилось на 177, 2% (р=0, 0383), в то время как количество антиапоптотического белка Bcl-xL увеличилось только на 51, 5% (р=0, 0107).
В то же время, 1 мМ СК при инкубации с ним культуры во время ГКД и 6-часовой реоксигенации или только во время 6-часовой реоксигенации не влиял на относительное количество этих белков по сравнению с культурой, инкубированной в ИЦСЖ в условиях нормоксии (рис. 17, А-В).
|
|  Б Б
| |
 В
В
|
Г | |
| Рисунок 17. Влияние 1 мМ салицил-карнозина на количество белков Bcl-2, Bcl-xL, Bak, нормированных на общее количество белка в соответствующих дорожках на мембране, в первичной культуре нейронов при инкубации с ним во время ГКД и реоксигенации или только во время реоксигенации. Культуры инкубировали в ИЦСЖ в условиях нормоксии («ИЦСЖ») или в ИЦСЖ без глюкозы в условиях гипоксии в течение 4 часов без добавления 1 мМ салицил-карнозина («ГКД») или с его добавлением во время ГКД и реоксигенации («ГКД+1мМ СК (ГКД+Р)») или только во время реоксигенации («ГКД+1мМ СК (Р)»). Для проверки нормальности распределений использовали тест Шапиро-Уилка. Для определения достоверности различий использовали однофакторный дисперсионный анализ. На графиках представлено среднее ± стандартное отклонение, n=6. * - p< 0, 05, ** - p< 0, 01, *** - p< 0, 001, **** - p< 0, 0001. | ||
Антиапопототический белок Bcl-xL инактивирует проапоптотический белок Bax (Stevens, Oltean, 2019). Проапоптотический белок Bak участвует в образовании поры в митохондриальной мембране, способствуя выходу цитохрома с из матрикса митохондрии в цитоплазму и активации митохондриального пути апоптоза (Datta et al., 2020). Количество антиапоптотического белка Bcl-xL может увеличиваться в качестве компенсаторного механизма. Увеличение количества проапоптотичсекого белка Bak превышает увеличение количества Bcl-xL в несколько раз. Опираясь на полученные данные, можно предположить, что 1 мМ салицил-карнозин вызывает снижение количества проапоптотического белка Bak в культуре, инкубированной с ним во время ГКД и 6-часовой реоксигенации или только во время 6-часовой реоксигенации, то есть его нейропротекторный эффект может быть связан с предотвращением митохондриального пути апоптоза.
Согласно полученным данным нейропротекторный эффект салицил-карнозина в условиях ГКД с последующей реоксигенацией связян с уменьшением деградации Akt, а также с увеличением активации ERK1/2 относительно контроля после 1-часовой реоксигенации и уменьшением активации ERK1/2 после 6-часовой рекосигенации отнсительно культуры, инкубированной в условиях ГКД и реоксигенации без веществ. Нейропротекторный эффект салицил-карнозина не связан с активацией PKCγ. Гибель нейронов в этой модели не связана с действием киназы JNK. Также в данной модели не было выявлено изменений количества транскрипционного фактора Nrf2, но при ГКД увеличивается количество проапоптотического белка Bak и антиапоптотического белка Bcl-xL, причем количество Bak увеличивается больше, а салицил-карнозин может препятствовать росту Bak, и тем самым предотвращает развитие митохондриального пути апоптоза.
6. 3. Влияние салицил-карнозина, ацетилсалициловой кислоты, карнозина на жизнеспособность первичной культуры клеток коры больших полушарий мозга крыс в модели NMDA-индуцированной эксайтотоксичности
Через 24 часа после моделирования NMDA-индуцированной эксайтотоксичности проводили МТТ-тест для оценки жизнеспособности культуры клеток и измеряли активность ЛДГ в среде для оценки гибели нейронов.
Таблица 11. Жизнеспособность нейронов согласно МТТ-тесту и активность фермента ЛДГ в среде относительно активности ЛДГ и жизнеспособности культуры, инкубированной в NBM без антиоксидантов в течение 15 минут (принята за 100%). NBM - neurobasal medium, нейробазальная среда, ИЦСЖ - искусственная цереброспинальная жидкость, NMDA - N-метил-D-аспартат, МК-801 - антагонист NMDA-рецепторов. В таблице представлено среднее ± стандартное отклонение, n=6-12.
| NBM без антиокси- дантов | ИЦСЖ | 100 мкМ NMDA в ИЦСЖ без Mg2+ | 100 мкМ NMDA в ИЦСЖ без Са2+ и Mg2+ | 50 мкМ МК-801 и 100 мкМ NMDA в ИЦСЖ без Mg2+ | |
| Жизнеспо- собность культуры согласно МТТ-тесту, % | 100±7, 83 | 93, 06±6, 89 | 70, 96±4, 84 | 89, 94±4, 63 | 102, 1±5, 2 |
| NBM без антиокси- дантов | ИЦСЖ | 100 мкМ NMDA в ИЦСЖ без Mg2+ | 100 мкМ NMDA в ИЦСЖ без Са2+ и Mg2+ | 50 мкМ МК-801 и 100 мкМ NMDA в ИЦСЖ без Mg2+ | |
| Активность ЛДГ в среде, % | 100±8, 5 | 73, 75±10, 75 | 175, 5±15, 22 | 89, 41±3, 96 | 60, 72±4, 97 |
Для проверки корректности полученных данных провели предварительный эксперимент, который подтвердил, что в данной модели на гибель нейронов влияет кальциевый ток, поступающий в клетки через NMDA-рецепторы. В этом эксперименте выживаемость и гибель нейронов в культуре, инкубированной в NBM без антиоксидантов, статистически значимо не отличались от выживаемости и гибели нейронов в культуре, инкубированной в ИЦСЖ в течение 15 минут (табл. 11, рис. 18). То есть, ИЦСЖ не влияет на эти параметры. В то же время, 15-минутная инкубация культуры в ИЦСЖ, содержащей 100 мкМ NMDA и не содержащей ионы магния, приводила к снижению жизнеспособности культуры на 29, 04% (p< 0, 0001) относительно культуры, инкубированной в NBM без антиоксидантов и на 22, 1% (р=0, 0005) относительно культуры, инкубированной в ИЦСЖ в течение 15 минут, согласно МТТ-тесту и увеличивала активность ЛДГ в среде на 101, 75% (р=0, 0001) относительно культуры, инкубированной в ИЦСЖ в течение 15 минут (рис. 18).
В условиях инкубации нейронов со 100 мкМ NMDA, растворенным в ИЦСЖ, не содержащей ионов магния и кальция, жизнеспособность культуры также уменьшилась по сравнению с культурой, инкубированной в NBM без антиоксидантов на 10, 06% (р=0, 0455) согласно МТТ-тесту, однако различия были менее выраженными, чем в группе, инкубированной с NMDA, растворенным в ИЦСЖ без магния, в которой жизнеспособность уменьшилась на 29, 04% (p< 0, 0001) (рис. 18).
По результатам измерения активности ЛДГ, в ИЦСЖ без ионов магния и кальция, содержащей NMDA, активность ЛДГ в среде не изменилась относительно культуры, инкубированной в ИЦСЖ, содержащей эти ионы, но не содержащей NMDA, в то время как в культуре, инкубированной с NMDA, растворенным в ИЦСЖ без магния, активность ЛДГ в среде увеличилась на 101, 75% (р=0, 0001) (рис. 18). Таким образом, в данном исследовании именно ионы кальция, попадающие в нейроны при активации NMDA-рецепторов, вызывают эксайтотоксичность.
При добавлении к культуре антагониста NMDA-рецепторов МК-801 и последующей её инкубации в среде, содержащей 100 мкМ NMDA, растворенный в ИЦСЖ, не содержащей ионов магния, жизнеспособность культуры не менялась п
|
|
|



 А
А