 |
Лабораторная работа № 1. Свойства р-элементов IV группы. Периодической системы Д.И. Менделеева – углерод. Опыт 1. Адсорбционные свойства угля
|
|
|
|
Лабораторная работа № 1
Свойства р-элементов IV группы
Периодической системы Д. И. Менделеева – углерод
Приборы и реактивы: стеклянные пробирки; пипетка капельная; при-боры для получения оксида углерода и диоксида углерода.
Сухие вещества: уголь активированный; уголь древесный (порошок); оксид меди.
Растворы: жидкого брома; нитрата свинца (0, 01 н. ); иодида калия
(0, 1 н. ); нитрата серебра (0, 1 н. ); карбоната натрия (0, 5 н. ); хлорида железа (III) (0, 5 н. ); хлорида олова (0, 5 н. ); серной кислоты (2 н.; концентрирован-
ная); гидроксида натрия (2 н. ); гидроксида аммония (25%); муравьиной кислоты.
Опыт 1. Адсорбционные свойства угля
А. Абсорбция газообразных веществ
Опыт проводить в вытяжном шкафу!
Выполнение работы. Наполнить пробирку газообразным бромом. Для этого стеклянную палочку опустить в сосуд с жидким бромом на глубину 1 см. Смоченную жидким бромом палочку осторожно опустить в пробирку и коснуться ею дна. Быстро вынуть палочку и в пробирку, заполненную парами брома, всыпать немного порошка угля. Плотно закрыть пробирку пробкой
и энергично встряхнуть ее несколько раз. Наблюдать обесцвечивание газа в пробирке.
Б. Адсорбционные свойства угля – адсорбция ионов из раствора
Выполнение работы. В пробирку внести 2–3 капли 0, 01 н. раствора ни-трата свинца. Добавить к нему одну каплю 0, 1 н. раствора иодида калия. На-блюдать выпадение осадка иодида свинца. Пробирку с полученным осадком сохранить для сравнения. В другую пробирку до половины ее объема налить того же раствора нитрата свинца и внести небольшое количество (1 шпатель) порошка активированного угля. Закрыв отверстие пробирки пальцем, энергично встряхивать ее 2–3 минуты. Дать раствору отстояться, после чего капельной пипеткой отобрать 3–4 капли прозрачного раствора и перенести его в другую пробирку. Добавить туда же одну каплю 0, 1 н. раствора KI. Сравнить количество осадка иодида свинца, полученного в первом и втором случае. Чем объяснить различие?
|
|
|
Запись данных опыта. Описать наблюдаемое. Составить уравнение реакции.
Опыт 2. Восстановительные свойства угля
А. Восстановление углем оксида меди
Выполнение работы. На листе фильтровальной бумаги смешать один объем порошка оксида меди с двумя объемами порошка угля. Приготовленную смесь поместить в цилиндрическую пробирку, которую укрепить в штативе горизонтально.
Нагревать смесь сильным пламенем горелки в течение 10–12 минут, наблюдая сильное раскаливание смеси. После охлаждении пробирки, высы-пать ее содержимое на лист белой бумаги. Отметить цвет полученного продукта. Обратить внимание на блестящий красноватый налет, образовав-шийся на стенках пробирки и объяснить его образование. Написать уравне-ние реакции.
Б. Восстановление углем серной кислоты
Выполнение работы. В цилиндрическую пробирку поместить 2–3 капли серной кислоты (концентрированной) и маленький кусочек угля. Укрепить колбочку в штативе и на маленьком пламени горелки осторожно подогреть ее. Наблюдать выделение пузырьков газа. По запаху определить один из вы-деляющихся газов.
Запись данных опыта. Написать уравнение реакции, учитывая, что углерод окисляется до диоксида углерода. Какое вещество восстановилось?
Опыт 3. Восстановительные свойства оксида углерода (II)
Опыты 3А и 3Б проводить в вытяжном шкафу!
А. Восстановление серебра
Выполнение работы. Приготовить раствор [Ag(NH3)2]OH, для чего в пробирку внести 3 капли раствора нитрата серебра и 1–2 капли 2 н. раствора гидроксида натрия. Выпавший осадок оксида серебра растворить в одной капле 25%-го раствора гидроксида аммония.
|
|
|
Получить оксид углерода ( опыт необходимо проводить только в вытяжном шкафу! ): в колбочку внести 2–3 капли серной кислоты (кон-центрированной) и 4–5 капель муравьиной кислоты НСООН. Затем колбочку с реакционной смесью укрепить в штативе, закрыть пробкой с изогнутой газоотводной трубкой, конец которой опустить в пробирку с раствором ком-плексного соединения серебра (рис. 1). Реакционную смесь слегка подогреть и выделяющийся газ пропускать в раствор до выделения металлического серебра в коллоидном состоянии.
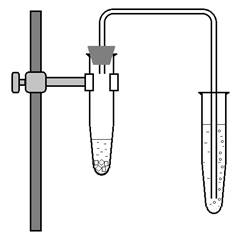
Рис. 1. Установка для поглощения газа жидкостью
Запись данных опыта. Написать уравнения реакций:
а) получения оксида серебра взаимодействием нитрата серебра с гидроксидом натрия;
б) образования комплексного соединения серебра при взаимодействии оксида серебра с гидроксидом аммония;
в) восстановления серебра из его комплексного соединения оксидом углерода (II), протекающего по уравнению:
2[Ag(NH3)2]OH + СО ® 2Ag + 4NH3 + Н2О + СО2.
Б. Восстановление дихромата калия
Выполнение работы. В пробирку с раствором К2Сr2О7 (2–3 капли) до-бавить 1–2 капли 2 н. серной кислоты и 1 каплю раствора Hg(NO3)2 в качестве катализатора. Пропускать СО в приготовленный раствор до изменения его окраски. Написать уравнение реакции восстановления дихромата калия до сульфата хрома (III). В какое соединение окислился оксид углерода (II)?
|
|
|


