 |
Опыт 2. Равновесие в водном растворе гидроксида аммония
|
|
|
|
Опыт 2. Равновесие в водном растворе гидроксида аммония
Выполнение работы. Полученный в опыте 1 раствор гидроксида аммония разделить на две пробирки. В одну из них добавить одну каплю фенолфталеина. Отметить окраску раствора. На присутствие каких ионов она указывает? Добавить в раствор 1 шпатель хлорида аммония и размешать раствор. Как изменилась интенсивность окраски? Почему? К раствору гидроксида аммония во второй пробирке добавить 5–6 капель раствора сульфата алюминия. Отметить исчезновение запаха аммиака.
Запись данных опыта. Написать:
а) схему равновесия в водном растворе аммиака;
б) молекулярное и ионное уравнения реакции взаимодействия сульфата алюминия с водным раствором гидроксида аммония.
Указать, в каком направлении смещается равновесие в водном растворе гидроксида аммония при добавлении к нему хлорида аммония, сульфата алюминия? Как при этом изменяется концентрация компонентов данной равновесной системы: иона ОН-, она NH4+, NH3? В каком направлении сместится равновесие данной системы при добавлении хлороводородной кислоты? Почему?
Опыт 3. Восстановительные свойства аммиака
Выполнение работы. В три пробирки внести раздельно по 3–4 капли растворов:
а) бромной воды;
б) перманганата калия;
в) дихромата калия.
В каждую из пробирок добавить по 3–5 капель 25%-го раствора гидроксида аммония. В каждом случае растворы слегка подогреть до изменения их окраски.
Запись данных опыта. Написать соответствующие уравнения реакций, учитывая, что в каждом случае гидроксид аммония в основном окисляется до молекулярного, КМnО4 восстанавливается до МnО2, а К2Сr2O7 – до Сr2О3. Во всех случаях отметить изменение окраски растворов.
|
|
|
Опыт 4. Гидролиз солей аммония
Выполнение работы. В три пробирки налить по 5–6 капель нейтрального раствора лакмуса. В каждую из пробирок раздельно добавить по 1/2 шпателя кристаллов хлорида, нитрата и ацетата аммония. Каждый раствор перемешать чистой стеклянной палочкой.
Запись данных опыта. Отметить изменение окраски лакмуса в каждом случае. Написать в молекулярном и ионном виде соответствующие уравнения реакций гидролиза. Реакцию гидролиза солей аммония можно рассматривать как реакцию депротонирования иона NH4+:
NH4+ + H2O « NH3 + H3O+.
Опыт 5. Качественная реакция на ион NH4+
Выполнение работы. В пробирку внести 2–3 капли раствора соли аммония и добавить столько же 2 н. раствора гидроксида натрия. Слегка нагреть пробирку и над ее отверстием подержать влажную красную лакмусовую бумажку. По запаху и по изменению цвета лакмусовой бумажки убедиться в выделении аммиака и образовании иона ОН-.
Запись данных опыта. Написать в молекулярной и ионной форме уравнение реакции. Можно ли этой реакцией обнаружить ион NH4+ в при-сутствии солей КСl, NaNO3? Ответ мотивировать.
Опыт 6. Получение оксида и диоксида азота
и исследование их свойств
Выполнение работы. В маленький кристаллизатор или фарфоровую чашку налить дистиллированной воды. Коническую пробирку наполнить водой, закрыть отверстие пальцем и, перевернув вверх дном, поместить в кристаллизатор. Открывая под водой пробирку, следить, чтобы вода из нее не вылилась, и в нее не проник воздух.
В колбочку с газоотводной трубкой (рис. 3) поместить 2–3 маленьких кусочка медной стружки и 2–4 капли разбавленной азотной кислоты. Колбочку укрепить в штативе вертикально и, если реакция идет недостаточно энергично, слегка подогреть маленьким пламенем горелки. Газоотводную трубку опустить в кристаллизатор и подвести под пробирку с водой. Заполнив пробирку выделяющимся газом примерно на 3/4 ее объема (в пробирке должна остаться вода), закрыть ее под водой пальцем, и, вынув из воды, перевернуть дном вниз. Открыв на 1–2 секунды отверстие пробирки, наблюдать побурение бесцветного газа. Пробирку держать на белом фоне. Закрыв пробирку пальцем, встряхнуть ее несколько раз до полного поглощения водой полученного бурого таза. Снова открыть пробирку и наблюдать побурение газа вторично и его растворение в воде при встряхивании. К полученному раствору добавить 1–2 капли нейтрального раствора лакмуса. Отметить изменение окраски и сделать вывод о реакции среды в растворе.
|
|
|
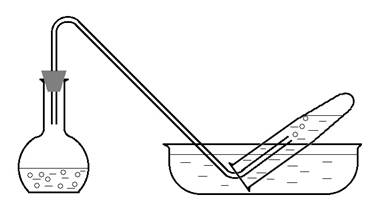
Рис. 3. Установка для получения газа
Запись данных опыта. Описать наблюдаемые явления. Написать уравнения реакций:
а) получения оксида азота (II) взаимодействием меди с разбавленной азотной кислотой;
б) окисления оксида азота (II) до диоксида и реакцию димеризации последнего. Написать графические и электронные формулы этих оксидов. Чем объясняется легкая окисляемость NO и способность NO2 к полимеризации?
в) взаимодействия NO2 с водой, сопровождающегося образованием азотной кислоты и оксида азота (II).
|
|
|


