 |
Химические свойства металлов. Взаимодействие металлов с концентрированными и разбавленными кислотами и щелочами
|
|
|
|
| МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «Тверской государственный технический университет» (ТвГТУ) | ||||
| Кафедра биотехнологии, химии и стандартизации | ||||
| Общие свойства металлов. Комплексные соединения. Свойства s-элементов Периодической системы Д. И. Менделеева | ||||
| Лабораторный практикум по неорганической химии для студентов, обучающихся по направлениям подготовки 04. 03. 01 Химия, 18. 03. 01 Химическая технология, 19. 03. 01 Биотехнология и специальности 04. 05. 01 Фундаментальная и прикладная химия | ||||
 Тверь 2021 Тверь 2021
| ||||
| УДК 546 ББК 24. 12
Рецензент: к. х. н., доцент, доцент кафедры химии и технологии полимеров Пичугина А. И.
Общие свойства металлов. Комплексные соединения. Свойства s-элементов Периодической системы Д. И. Менделеева: лабораторный практикум / В. Г. Матвеева [и др. ]. Тверь: ТвГТУ, 2021. 40 с.
Содержит краткие теоретические сведения о комплексных соединениях и общих свойствах металлов, лабораторный практикум, направленный на изучение общих свойств металлов, свойств s-элементов и комплексных соединений. Является составной частью курса «Неорганическая химия» для студентов, обучающихся по направлениям подготовки бакалавров 04. 03. 01 Химия, 18. 03. 01 Химическая технология, 19. 03. 01 Биотехнология и специальности 04. 05. 01 Фундаментальная и прикладная химия (очной и заочной форм обучения).
| ||||
| Рассмотрен и рекомендован к изданию на заседании кафедры био-технологии, химии и стандартизации (протокол № 16 от 12 мая 2021 г. ).
| ||||
|
| ||||
|
| ||||
|
| ||||
|
| ||||
|
© Тверской государственный технический университет, 2021 © В. Г. Матвеева, Г. Н. Демиденко, М. Е. Григорьев, А. Е. Филатова, К. Е. Сальникова, 2021 | ||||

Лабораторная работа № 1
Химические свойства металлов. Взаимодействие металлов с концентрированными и разбавленными кислотами и щелочами
Большинство элементов являются металлами. К металлам относятся s-, p-, d- и f-элементы. Из всех известных нам химических элементов более 80 яв-ляются металлами. В машино- и приборостроении они относятся к основным конструкционным материалам. В технике (но не в химии) к металлам часто причисляют также и некоторые металлоподобные соединения металлов (карбиды, нитриды и др. ), обладающие комплексом физико-химических свойств, характерных для металлов.
Граница между металлами и неметаллами размыта, между ними находятся полуметаллы (металлоиды). Полуметаллы обладают свойствами как металлов, так и неметаллов. Например, серый мышьяк имеет металлический блеск и электрическую проводимость, однако он хрупок, а желтый мышьяк имеет чисто неметаллические свойства.
Все металлы – восстановители. О восстановительных способностях металлов судят по стандартному электродному потенциалу, значение которого также является периодической функцией порядкового номера элемента. Поскольку потенциалы зависят не только от природы металлов и раствора, но и от степени окисления его ионов, сравнение потенциалов необходимо проводить либо при одинаковой, либо при максимальной степени окисления. Однако пока это невозможно из-за отсутствия всех термодинамических данных, поэтому стандартные потенциалы (при 298 К) обычно относятся к ионам со степенью окисления, равной номеру группы.
|
|
|
К наиболее сильным восстановителям относятся щелочные, щелочно-земельные металлы, а также бериллий, магний, алюминий, d-металлы III и IV групп. Наиболее положительные электродные потенциалы имеют d-металлы I группы и платиновые металлы.
В таблице на с. 8 представлены обобщенные данные по химическим свойствам металлов: основное внимание уделяется зависимости свойств металлов от величины стандартного электродного потенциала, которой можно объяснить различие в отношении металлов к разбавленным, концентриро-ванным кислотам и щелочам и обосновать способы получения металлов и нахождение их в природе.
Рассмотрим более подробно уравнения реакций металлов с различными разбавленными и концентрированными кислотами:
а) реакция металлов с хлороводородной кислотой HCl, как кон-центрированной, так и разбавленной, происходит с образованием хлорида металла и выделением водорода Н2 для всех металлов, расположенных в ряду стандартных электродных потенциалов левее водорода, то есть металлов, стандартный электродный потенциал которых меньше нуля (например, j0Co/Co2+ = –0, 28 В):
Co + 2HCl ® CoCl2 + H2

б) реакция металла с разбавленной серной кислотой H2SO4 происходит с образованием сульфата металла и выделением водорода Н2 для всех металлов, расположенных в ряду стандартных электродных потенциалов левее водорода, то есть металлов, стандартный электродный потенциал которых меньше нуля (например, j0Cd/Cd2+ = –0, 40 В):
Cd + H2SO4 ® CdSO4 + H2

Следует отметить, что некоторые металлы, например свинец, пассивируются в растворах хлороводородной и серной кислот нерастворимыми хлоридами или сульфатами соответственно.
в) при составлении уравнений реакций металлов с концентрированной серной кислотой необходимо помнить следующее: в зависимости от величины стандартного электродного потенциала металла и температуры продукты восстановления серной кислоты могут быть различными (водород не вы-деляется):
|
|
|
Н2SO4 → SO2 → S → H2S.
Все металлы, включая Ag (j0Ag/Ag+ = +0, 799 В), при комнатной температуре реагируют с концентрированной серной кислотой. Реакция, как правило, сопровождается выделением оксида серы (IV) для малоактивных металлов (например, j0Cu/Cu2+ = +0, 338 В):
Cu + Н2SO4(конц) → CuSO4 + SO2 + H2O

Если стандартный электродный потенциал металла значительно меньше нуля (например, Са, Mg, Al, Zn), то продуктами реакции являются сера S или сероводород H2S и сульфат металла (например, jº Mg/Mg2+ = –2, 36 В):
4Mg + 5Н2SO4(конц) → 4Mg(SO4)2 + H2S + 4H2O

Следует отметить, что некоторые металлы, например железо, алюминий, холодная концентрированная серная кислота, пассивирует в результате образования плотной оксидной пленки;
г) практически все металлы, кроме Au, Pt, Ta, Rh, Ir, окисляются концентрированной азотной кислотой с образованием нитрата и выделением газа NO2 (например, j0Ag/Ag+ = +0, 799 В):
Ag +2HNO3(конц) → AgNO3 + NO2 +H2O

Многие конструкционные металлы (например, Fe, Cr, Al) концентри-рованная азотная кислота на холоде пассивирует (происходит образование плотной оксидной пленки, нерастворимой в кислоте);
д) в зависимости от величины стандартного электродного потенциала металла и степени разбавления азотной кислоты, в качестве продуктов восстановления разбавленной азотной кислоты выделяются любые продукты, кроме NO2. При составлении уравнений реакций пользуются схемой вос-становления металлов азотной кислоты:
HNO3 → NO2 → N2O3 → NO → N2O → N2 → NH3 (NH4NO3).
Например: j0Cu/Cu2+ = +0, 338 В,
3Cu + 8HNO3(разб. ) → 3Cu(NO3)2 + 2NO + 4H2O

j0Mg/Mg2+ = –2, 372 В,
4Mg + 10HNO3(разб. ) → 4Mg(NO3)2 + N2O + 5H2O
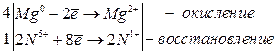
j0Al/Al3+ = –1, 70 В;
8Al + 30HNO3(оч. разб. ) → 8Al(NO3)3 + 3NH4NO3 + 9H2O

е) благородные металлы (Au, Pt) растворяются в «царской водке»
(1 объем концентрированной HNO3 и 3–4 объема концентрированной HCl), например j0Au/Au3+ = + 1, 498 В:
Au + HNO3 + 3HCl → AuCl3 + NO + H2O

В горячей (более 230 0С) концентрированной селеновой кислоте H2SeO4 растворяется металлическое золото, образуется селенат золота (III) Au2(SeO4)3, например, j0Au/Au3+ = +1, 498 В.
|
|
|
2Au + 6H2SeO4 → Au2(SeO4)3 + 3SeO2 + 6H2O

ж) существуют особые случаи взаимодействия металлов с кислотами. К ним относят реакции поливалентных металлов (Sn, Sb, V, Mo, Ti, W), которые в высших степенях окисления проявляют неметаллические свойства. В реакциях с концентрированной HNO3, либо в смесях HNO3 и HCl, HNO3 и HF, они, как правило, окисляются до высшей степени окисления с образованием соответствующих кислот, например, j0Sn/Sn4+ = +0, 01 В.
Sn + 4HNO3 → H2SnO3 + 4NO2 + H2O

В реакциях с Sb, V, Ti образуются соответственно сурьмяная H3SbO4, ванадиевая HVO3 и титановая H2TiO3 кислоты.
Металлы W, Mo, Pt взаимодействуют со смесью кислот HNO3 и HF с образованием комплексных кислот H2[WF8], H2[MoF6] и H2[PtF6] соответ-ственно (например, j0W/W6+ = + 0, 68 В):
W + 2HNO3 + 8HF → H2[WF8] + 2NO + 4H2O
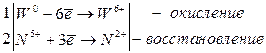
Металлы, являющиеся амфотерными элементами (Al, Ga, Zn, Sn, Pb и др. ), окисляются в водных растворах щелочей с образованием солей (алюмината, галлата, цинката, станната, плюмбата и др. ) и выделением про-дуктов восстановления.
Если стандартный электродный потенциал металла меньше нуля, то восстанавливается водород:
Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2.
Если стандартный электродный потенциал больше нуля, то для окисления необходим более сильный окислитель, чем вода, например перекись водорода Н2О2:
2Sb + 6NaOH + 3H2O2 → 2Na3[Sb(OH)6]
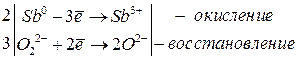
Приборы и реактивы: стеклянные пробирки, стеклянные палочки.
Сухие вещества: медь, железо, алюминий, цинк, магний, свинец, сурьма, висмут.
Растворы: хлороводородной кислоты (2 н.; концентрированная); азотной кислоты (2 н., концентрированная); серной кислоты (2 н.; концентрированная); гидроксида натрия (2 н.; концентрированный).
Перед проведением опытов получить у преподавателя два металла.
|
|
|


