 |
Опыт 1. Взаимодействие металлов
|
|
|
|
Опыт 1. Взаимодействие металлов
с разбавленными кислотами и щелочами
Выполнение работы. В 4 пробирки внести по небольшому кусочку металла и добавить в каждую пробирку 5–6 капель 2 н. растворов хлоро-водородной, серной и азотной кислот, гидроксида натрия. Что наблюдается в каждой пробирке? Если реакция отсутствует, осторожно нагреть пробирку. Повторить опыт для второго металла.
Запись данных опыта. Описать наблюдаемые явления и сделать выводы.
Написать уравнения реакций взаимодействия металлов с разбавленными кислотами и гидроксидом натрия.
Опыт 2. Взаимодействие металлов
с концентрированными кислотами и щелочами
Выполнение работы. В 4 пробирки внести по небольшому кусочку металла и добавить в каждую пробирку 5–6 капель концентрированных растворов хлороводородной, серной и азотной кислот, гидроксида натрия ( в вытяжном шкафу! ). Что наблюдается в каждой пробирке? Если реакция отсутствует, осторожно нагреть пробирку. Повторить опыт для второго ме-талла.
Запись данных опыта. Описать наблюдаемые явления и сделать выводы.
Написать уравнения реакций взаимодействия металлов с концентри-рованными кислотами и гидроксидом натрия.
Общие свойства металлов
| Свойства |
Li K Rb Ba Ca Na Mg Be Al Mn Zn Cr Ga Fe Cd Ti Tl Co Sn Pb |
H |
Sb Bi As Cu Hg Ag Pd Pt Au | ||||||||||||
| jº, В | –3, 04 –2, 71 –1, 70 –0, 76 –0, 44 –0, 13 | +0, 24 +0, 34 +0, 80 +1, 50 | |||||||||||||
| Нахождение в природе | Только в виде соединений | В виде соединений | Самород-ное со-стояние | ||||||||||||
| Получение | Электролиз расплава | Восстановление оксидов, электролиз водных растворов
| Нагрев соеди-нений | Отмыв | |||||||||||
| Восстановитель-ная активность металла |
® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® Ослабевает ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® | ||||||||||||||
| Окислительная активность катиона Меn+ |
® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® Возрастает ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® ® | ||||||||||||||
| Окисляемость кислородом | Быстро окисляются | Окисляются на воздухе | Окисляются | Не окисляются | |||||||||||
| Взаимодействие с водой | Вытесняют Н2 при комнатной температуре | Вытесняют Н2 при нагревании | С водой не взаимодействуют | ||||||||||||
| Взаимодействие с HCl(конц), (разб), H2SO4(pазб) |
| Не взаимодействуют | |||||||||||||
| Взаимодействие с H2SO4(конц) |
|
| Не реаги-руют | ||||||||||||
| Взаимодействие с HNO3(разб) |
|
| Не реаги-руют | ||||||||||||
| Взаимодействие с HNO3(конц) |
| Не реаги-руют | |||||||||||||
Лабораторная работа № 2
Амфотерные гидроксиды металлов
Приборы и реактивы: стеклянные пробирки; стеклянные палочки; шпатель; пинцет.
Сухие вещества: соль Мора.
Синяя лакмусовая бумажка.
Растворы: хлороводородной кислоты (2 н. ); азотной кислоты (2 н. ); серной кислоты (2 н. ); нитрата или ацетата свинца (0, 5 н. ); гидроксида натрия (2 н. ); дихромата калия (0, 5 н. ); хлорида олова (II) (0, 5 н. ); хлорида алюминия (0, 5 н. ); сульфата алюминия (0, 5 н. ); сульфата кадмия (2 н. ); сульфата цинка (2 н. ); хлорида сурьмы (0, 5 н. ); нитрата висмута (0, 5 н. ).
Опыт 1. Гидроксид алюминия, его получение и свойства
Выполнение работы. В две пробирки внести по 2–3 капли раствора сульфата алюминия и по 2–3 капли 2 н. раствора гидроксида натрия до образования осадка гидроксида алюминия. В одну пробирку к полученному осадку прибавить 3–5 капель 2 н. раствора хлороводородной кислоты, в другую – столько же 2 н. раствора гидроксида натрия. Что происходит в обоих случаях?
|
|
|
Запись данных опыта. Сделать вывод о свойствах гидроксида алю-миния.
Написать уравнения реакций: получения гидроксида алюминия и его взаимодействия с хлороводородной кислотой и гидроксидом натрия, учитывая, что в щелочной среде образуется комплексный анион [А1(ОН)6]3-. Указать названия полученных соединений алюминия. Написать схему равновесия диссоциации гидроксида алюминия. Как изменяется концентрация ионов А13+ и [А1(ОН)6]3- при добавлении кислоты? При добавлении щелочи?
|
|
|




 (пассивируются Al и Fe)
(пассивируются Al и Fe)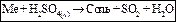
 (пассивируется Ti)
(пассивируется Ti)
 (пассивируются Al, Ni, Cr, Ti и Fe)
(пассивируются Al, Ni, Cr, Ti и Fe)